题目内容
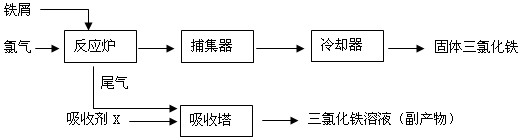
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K.工业上制备无水FeCl3的一种工艺如下:

(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为:
(2)吸收塔中吸收剂X是
(3)温度超过673K,捕集器中的物质相对分子质量为325,该物质的分子式为
(4)通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL.则样品中氯化铁的质量分数为:
%
%.

(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片得红褐色氢氧化铁胶体,其离子方程式可表示为:
Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
,胶体粒子的直径一般不超过
| ||
100nm
100nm
.(2)吸收塔中吸收剂X是
FeCl2溶液
FeCl2溶液
.(3)温度超过673K,捕集器中的物质相对分子质量为325,该物质的分子式为
Fe2Cl6
Fe2Cl6
.(4)通常用碘量法测定FeCl3的质量分数:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL.则样品中氯化铁的质量分数为:
| 162.5cV |
| m |
| 162.5cV |
| m |
分析:(1)三氯化铁溶液滴入50ml沸水中,再煮沸片刻得红褐色透明液体,形成氢氧化铁胶体;
胶体粒子的直径介于1nm~100nm之间;
(2)尾气中含有过量的氯气和少量氯化铁烟气,由工艺流程可知,用吸水剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,同时溶解氯化铁烟气;
(3)分子中Fe原子与Cl原子数目之比为1:3,令分子组成为(FeCl3)n,根据相对分子质量计算n值,确定物质的分子式;
(4)VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol,mg样品需要0.01cVmolNa2S2O3,根据关系式2Fe3+~I2~S2O32-计算n(Fe3+),氯化铁的物质的量等于n(Fe3+),利用m=nM计算氯化铁的质量,根据质量分数定义计算.
胶体粒子的直径介于1nm~100nm之间;
(2)尾气中含有过量的氯气和少量氯化铁烟气,由工艺流程可知,用吸水剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,同时溶解氯化铁烟气;
(3)分子中Fe原子与Cl原子数目之比为1:3,令分子组成为(FeCl3)n,根据相对分子质量计算n值,确定物质的分子式;
(4)VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol,mg样品需要0.01cVmolNa2S2O3,根据关系式2Fe3+~I2~S2O32-计算n(Fe3+),氯化铁的物质的量等于n(Fe3+),利用m=nM计算氯化铁的质量,根据质量分数定义计算.
解答:解:(1)取0.5ml三氯化铁溶液滴入50ml沸水中,再煮沸片刻得红褐色透明液体,形成氢氧化铁胶体,该过程可用离子方程式为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;
胶体粒子的直径介于1nm~100nm之间,故胶体粒子的直径一般不超过100nm,
故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+;100nm;
(2)尾气中含有过量的氯气和少量氯化铁烟气,由工艺流程可知,用吸水剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,同时溶解氯化铁烟气,
故答案为:FeCl2溶液;
(3)分子中Fe原子与Cl原子数目之比为1:3,令分子组成为(FeCl3)n,该分子相对分子质量为325,则:
(56+35.5×3)×n=325,解得,n=2,所以该物质的分子式为Fe2Cl6,
故答案为:Fe2Cl6;
(4)VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol,则:
根据关系式:2Fe3+~~~~~I2~~~~~~2S2O32-
2 2
n(Fe3+) c?V?10-3 mol×10
所以 n(Fe3+)=c?V?10-3 mol×10=0.01cVmol,
所以m克无水氯化铁样品中氯化铁的质量为0.01cVmol×162.5g/mol=1.625cVg
所以m克无水氯化铁样品中氯化铁的质量分数为
×100%=
%.
故答案为:
%.
| ||
胶体粒子的直径介于1nm~100nm之间,故胶体粒子的直径一般不超过100nm,
故答案为:Fe3++3H2O
| ||
(2)尾气中含有过量的氯气和少量氯化铁烟气,由工艺流程可知,用吸水剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,同时溶解氯化铁烟气,
故答案为:FeCl2溶液;
(3)分子中Fe原子与Cl原子数目之比为1:3,令分子组成为(FeCl3)n,该分子相对分子质量为325,则:
(56+35.5×3)×n=325,解得,n=2,所以该物质的分子式为Fe2Cl6,
故答案为:Fe2Cl6;
(4)VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol,则:
根据关系式:2Fe3+~~~~~I2~~~~~~2S2O32-
2 2
n(Fe3+) c?V?10-3 mol×10
所以 n(Fe3+)=c?V?10-3 mol×10=0.01cVmol,
所以m克无水氯化铁样品中氯化铁的质量为0.01cVmol×162.5g/mol=1.625cVg
所以m克无水氯化铁样品中氯化铁的质量分数为
| 1.625cV g |
| m g |
| 162.5cV |
| m |
故答案为:
| 162.5cV |
| m |
点评:本题考查学生对工艺流程的理解、物质的分离提纯等基本操作、氧化还原反应滴定应用、溶度积有关计算等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.注意(4)中计算,mg样品需要Na2S2O3的体积为滴定中的10倍,容易忽略.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K.工业上处理无水FeCl3的一种工艺如图所示:

(1)取0.5ml三氯化铁溶液滴入50ml沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为:______.
(2)表中是六水合氯化铁在水中的溶解度.
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度/g | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:______.
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液PH为2.7时,Fe3+开始沉淀;当溶液PH为4时,c(Fe3+)=______mol/L(已知:Ksp[Fe(OH)3]=1.1×10-36).
(5)吸收剂X是______;吸收塔中吸收剂X的作用是______.
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100ml容量瓶,用蒸馏水定容;取出10.00ml,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32-═2I-+S4O62-),共用去V ml.则样品中氯化铁的质量分数为______.