题目内容
简答题
(1)盐碱地因含较多的NaCl、Na2CO3,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性.用离子方程式和必要的文字解释CaSO4的作用
(2)SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂.将SOCl2与FeCl3?6H2O混合并加热,可得到无水FeCl3,得到无水FeCl3的化学方程式为
(1)盐碱地因含较多的NaCl、Na2CO3,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性.用离子方程式和必要的文字解释CaSO4的作用
石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 CaSO4+CO32-=CaCO3+SO42-,CO32-浓度降低,使得CO32-+H2O?HCO3-+OH-,平衡向左移动,OH-浓度降低,碱性减弱
石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 CaSO4+CO32-=CaCO3+SO42-,CO32-浓度降低,使得CO32-+H2O?HCO3-+OH-,平衡向左移动,OH-浓度降低,碱性减弱
.(2)SOCl2是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂.将SOCl2与FeCl3?6H2O混合并加热,可得到无水FeCl3,得到无水FeCl3的化学方程式为
FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑
FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑
.分析:(1)碳酸根离子水解显碱性,导致盐碱地产生碱性;石膏能与碳酸根离子反应,使碳酸根离子水解左移降低碱性;
(2)SOCl2与水反应生成的氯化氢会对氯化铁水解起到抑制作用;
(2)SOCl2与水反应生成的氯化氢会对氯化铁水解起到抑制作用;
解答:解:(1)酸根离子水解显碱性,导致盐碱地产生碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,石膏能与碳酸根离子反应,平衡向左移动,OH-浓度降低,降低碱性,石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 离子反应为:CO32-+CaSO4═SO42-+CaCO3;
故答案为:石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 CaSO4+CO32-=CaCO3+SO42-,CO32-浓度降低,使得CO32-+H2O?HCO3-+OH-,平衡向左移动,OH-浓度降低,碱性减弱;
(2)使SOCl2与FeCl3?6H20混合并加热,可得到无水FeCl3,SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用,反应的 化学方程式为:FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑;
故答案为:FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑;
故答案为:石膏电离出的Ca2+与CO32-结合生成更难溶的CaCO3 CaSO4+CO32-=CaCO3+SO42-,CO32-浓度降低,使得CO32-+H2O?HCO3-+OH-,平衡向左移动,OH-浓度降低,碱性减弱;
(2)使SOCl2与FeCl3?6H20混合并加热,可得到无水FeCl3,SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用,反应的 化学方程式为:FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑;
故答案为:FeCl3+6H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑;
点评:本题考查了盐类水解的原理和应用,水解平衡的影响因素判断,平衡移动方向的分析是解题关键,题目难度中等.

练习册系列答案
相关题目
 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有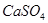 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释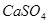 的作用 。
的作用 。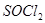 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将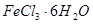 混合并加热,可得到无水
混合并加热,可得到无水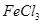 ,得到无水
,得到无水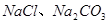 ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有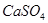 ,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释
,微溶于水)来降低土壤的碱性。用离子方程式和必要的文字解释 的作用
。
的作用
。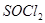 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将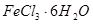 混合并加热,可得到无水
混合并加热,可得到无水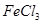 ,得到无水
,得到无水