题目内容
9.关于SO2的下列叙述中,正确的是( )| A. | SO2在有的反应中显示氧化性,有的反应中显示还原性 | |
| B. | SO2是酸性氧化物,溶于水生成稳定的亚硫酸 | |
| C. | SO2气体通入Na0H溶液中一定得到Na2SO3 | |
| D. | SO2气体通入BaCl2溶液中,能生成白色沉淀 |
分析 A.依据二氧化硫中硫元素化合价判断;
B.亚硫酸具有强的还原性,不稳定;
C.少量二氧化硫与氢氧化钠反应生成亚硫酸钠,足量二氧化硫与氢氧化钠反应生成亚硫酸氢钠;
D.亚硫酸的酸性弱于盐酸.
解答 解:A.二氧化硫中硫元素化合价为+4价,可以升高到+6价,可以降低到0,所以二氧化硫既具有氧化性又具有还原性,在有的反应中显示氧化性,有的反应中显示还原性,故A正确;
B.亚硫酸具有强的还原性,不稳定,容易被氧气氧化生成硫酸,故B错误;
C.SO2气体通入Na0H溶液中,反应产物与二氧化硫的用量有关,二氧化硫少量生成亚硫酸钠,二氧化硫过量生成亚硫酸氢钠,故C错误;
D.亚硫酸的酸性弱于盐酸,依据强酸制备弱酸原理,SO2气体通入BaCl2溶液中,不会发生反应,故D错误;
故选:A.
点评 本题考查了二氧化硫的性质,明确二氧化硫的还原性、氧化性、酸性氧化物的性质是解题关键,注意物质氧化性判断方法:依据物质所含有元素化合价判断,题目难度不大.

练习册系列答案
相关题目
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显蓝色的溶液中:NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、NO${\;}_{3}^{-}$ | |
| C. | c(H+):c(OH-)=1012的溶液中:Mg2+、Al3+、NO${\;}_{3}^{-}$、Cl- | |
| D. | pH=0的溶液中:K+、Fe3+、SO${\;}_{4}^{2-}$、SCN- |
13.将过氧化钠投入FeCl2溶液中,可观察到的实验现象是( )
| A. | 有绿色气体产生 | B. | 没有沉淀生成 | ||
| C. | 有白色沉淀生成 | D. | 有红褐色沉淀生成 |
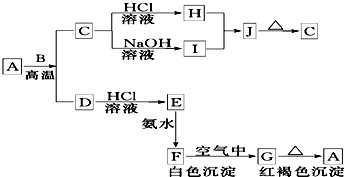 A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,C也是一种金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体,受热后容易发生分解.