题目内容
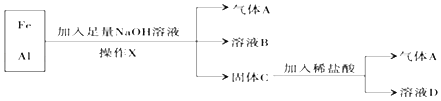
【题目】海水中蕴藏着丰富的资源,某学习小组在实验室模拟从海水提取氯化钠晶体,其实验流程如下:

通过查阅资料可知:粗盐中含有CaCl2、MgCl2、Na2SO4等杂质。该学习小组通过讨论,设计实验在从粗盐精制得到食盐水的过程为:
①取一定量的粗盐溶解;
②向粗盐水中依次加入过量的Na2CO3溶液、加入过量的NaOH、加入过量的BaCl2溶液;
③过滤;
④向滤液中加入适量盐酸。
回答:
(1)溶解时需要的仪器有________。
(2)加入过量的Na2CO3溶液时观察到的现象是________;反应的化学方程式为_______________________________。
(3)实验后,通过进一步反复论证,向老师求证,发现在粗盐精制得到食盐水的设计方案中________(“有”或“没有”)不妥之处,理由是______________________。
(4)该学习小组同学要从食盐水得到氯化钠晶体时,还要进行________、______、过滤。
(5)该学习小组同学用实验得到的晶体配制1mol·L-1的NaCl溶液500mL,在配制过程中,下列操作会引起浓度偏高的是________。
①没有洗涤烧杯和玻璃棒
②容量瓶不干燥,含有少量蒸馏水
③定容时仰视刻度线
④定容时俯视刻度线
【答案】烧杯、玻璃棒 溶液变浑浊,产生白色沉淀 Na2CO3+CaCl2=CaCO3↓+2NaCl 有 加入过量的BaCl2溶液时向盐水中引入杂质离子Ba2+,未进行去除 加热蒸发 冷却结晶 ④
【解析】
粗盐提纯,目的是要去除Ca2+,Mg2+和![]() 杂质离子,利用离子反应和物质的溶解性进行除杂,除杂顺序也要合理安排。第一步应该先加氯化钡溶液除去
杂质离子,利用离子反应和物质的溶解性进行除杂,除杂顺序也要合理安排。第一步应该先加氯化钡溶液除去![]() ,紧接着再加入碳酸钠溶液除去Ca2+的同时,也可以把第一步中的重金属离子Ba2+除去,随后加氢氧化钠溶液,除去Mg2+,最后加入适量盐酸,把第二步中过量的碳酸钠,和第三步中过量的NaOH反应消耗掉。如果不先脱除
,紧接着再加入碳酸钠溶液除去Ca2+的同时,也可以把第一步中的重金属离子Ba2+除去,随后加氢氧化钠溶液,除去Mg2+,最后加入适量盐酸,把第二步中过量的碳酸钠,和第三步中过量的NaOH反应消耗掉。如果不先脱除![]() ,那么后续步骤中无法将脱除
,那么后续步骤中无法将脱除![]() 过程中加入的Ba2+除去,产物不仅不纯,还会有毒。
过程中加入的Ba2+除去,产物不仅不纯,还会有毒。
(1)溶解需要将固体置于烧杯中加水,并用玻璃棒搅拌溶解;
(2)加入过量碳酸钠溶液的目的主要是去除杂质Ca2+,所以现象是溶液变浑浊,生成白色沉淀即CaCO3;
(3)题干中提供的方案非常不妥,因为脱除![]() 时加入溶液中的Ba2+无法去除;
时加入溶液中的Ba2+无法去除;
(4)由溶液获得结晶的操作是:蒸发浓缩,冷却结晶,过滤,洗涤,干燥;
(5)①由于未进行洗涤操作,会使溶质损耗,根据公式![]() 分析,浓度偏低,不符合;
分析,浓度偏低,不符合;
②容量瓶不干燥,对于结果无影响,不符合;
③定容时仰视刻度线会使![]() 偏大,根据公式
偏大,根据公式![]() 分析,浓度偏低,不符合;
分析,浓度偏低,不符合;
④定容时俯视刻度线会使![]() 偏小,根据公式
偏小,根据公式![]() 分析,浓度偏大,符合;
分析,浓度偏大,符合;
答案选④。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案