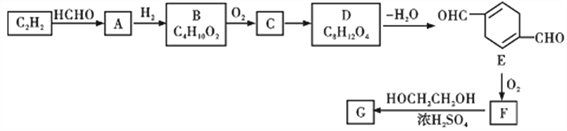
题目内容
【题目】常温下,向H2C2O4溶液中逐滴滴加NaOH溶液,若定义pc=-lgc,则所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)与溶液pH的关系如图所示。下列说法正确的是

A. 常溫下,Ka1(H2C2O4)=10-1.3
B. pH=x时,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. M点时,c(Na+)<2c(HC2O4-)+c(C2O42-)
D. ![]() 随pH的升高而增大
随pH的升高而增大
【答案】AC
【解析】定义pc=-lgc,所以纵坐标的数值越大,代表浓度应该越小。根据曲线随着pH的变化趋势,可以判断出来,I代表HC2O4-,Ⅱ代表H2C4O4,Ⅲ代表C2O42-。从图中得到pH=1.3的时候,c(H2C2O4)=c(HC2O4-),所以Ka1(H2C2O4)=![]() = c(H+)=10-1.3,选项A正确。纵坐标的数值越大,代表浓度应该越小,所以pH=x时,c(HC2O4-)>c(H2C2O4)=c(C2O42-),选项B错误。溶液中存在的电荷守恒式为:c(H+) + c(Na+) = c(HC2O4-) + 2c(C2O42-) + c(OH-),图中得到M点溶液为酸性,所以c(H+)>c(OH-),即c(Na+) < c(HC2O4-) + 2c(C2O42-),又因为M点表示c(C2O42-)=c(HC2O4-),所以c(HC2O4-) + 2c(C2O42-) = 2c(HC2O4-) + c(C2O42-),所以c(Na+)<2c(HC2O4-) + c(C2O42-),选项C正确。
= c(H+)=10-1.3,选项A正确。纵坐标的数值越大,代表浓度应该越小,所以pH=x时,c(HC2O4-)>c(H2C2O4)=c(C2O42-),选项B错误。溶液中存在的电荷守恒式为:c(H+) + c(Na+) = c(HC2O4-) + 2c(C2O42-) + c(OH-),图中得到M点溶液为酸性,所以c(H+)>c(OH-),即c(Na+) < c(HC2O4-) + 2c(C2O42-),又因为M点表示c(C2O42-)=c(HC2O4-),所以c(HC2O4-) + 2c(C2O42-) = 2c(HC2O4-) + c(C2O42-),所以c(Na+)<2c(HC2O4-) + c(C2O42-),选项C正确。![]() =
=![]() ,所以该式子是草酸两步电离平衡常数的比值,应该只与温度有关,选项D错误。
,所以该式子是草酸两步电离平衡常数的比值,应该只与温度有关,选项D错误。

练习册系列答案
相关题目