题目内容
【题目】铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,生产原理为:Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O
(1)配平并用单线桥法标出电子转移情况:___
___Fe(NO3)3+___NaOH+___Cl2→___Na2FeO4+___NaNO3+___NaCl+___H2O
(2)反应中的氧化剂是_____;还原产物是_____。
【答案】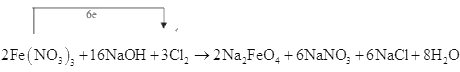 Cl2 NaCl
Cl2 NaCl
【解析】
配平氧化还原反应方程式时,首先要找出变价元素,确定首先配平的两种物质,然后按化合价升降总数相等进行配平,再利用质量守恒配其它物质的化学计量数。
(1)在反应Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O中,Fe由+3价升高到+6价,Cl由0价降低到-1价。
Fe +3→+6,升高3价,按化合价升降总数相等, 2Fe升高3价×2
Cl 0→-1,降低1价, 按化合价升降总数相等, 3Cl2降低2价×3
2Fe(NO3)3+NaOH+3Cl2→2Na2FeO4+NaNO3+6NaCl+H2O
再利用质量守恒配平:
2Fe(NO3)3+16NaOH+3Cl2→2Na2FeO4+6NaNO3+6NaCl+8H2O,
答案为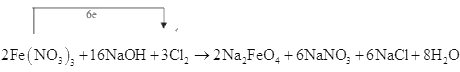 。
。
(2)在该反应中,Cl元素的化合价降低,Cl2作氧化剂;答案为Cl2。
还原产物是氧化剂对应的产物应为NaCl,答案为NaCl。

练习册系列答案
相关题目