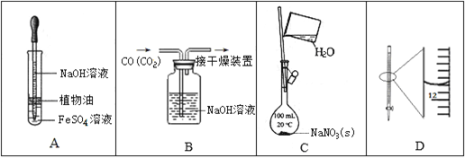
题目内容
【题目】化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) ![]() N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) ![]() 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) ![]() 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
【答案】C
【解析】
试题分析:A、平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,A错误;B、常温下水是液态,不能利用氢气燃烧生成气态水的平衡常数计算液态水分解的平衡常数,B错误;C、平衡常数大小能反应可逆反应进行的程度大小,所以根据平衡常数的相对大小可知常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为NO>H2O>CO2,C正确;D、根据以上分析可知D错误,答案选C。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲 | 容器乙 | 容器丙 | |
反应温度/℃ | 400 | 400 | 500 |
反应物投入量 | 1molN2,3molH2 | 4molNH3 | 1molN2,3molH2 |
平衡时v(正)(H2)/mol/(Ls) | v1 | v2 | v3 |
平衡时c(NH3)/(mol/L) | c1 | c2 | c3 |
平衡时总压强P/Pa | P1 | P2 | P3 |
物质的平衡转化率a | a1(N2) | a2(NH3) | a3(N2) |
平衡常数K | K1 | K2 | K3 |
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)