题目内容
1.现有pH相等且体积相等的H2SO4、HCl和CH3COOH三种溶液.请问;(1)将它们分别与等浓度的NaOH溶液恰好中和,消耗NaOH溶液体积分别为V1、V2、V3,问V1、V2、V3大小顺序为:V3>V2=V1
(2)将它们同等倍数稀释后,则CH3COOH溶液pH最小.
(3)三种溶液物质的量浓度大小顺序为c(CH3COOH)>c(HCl)>c(H2SO4)(用c(分子式)表示浓度 )
分析 H2SO4、HCl为强酸,pH相同、体积相同的H2SO4、HCl溶液中氢离子物质的量相同,需要氢氧根离子物质的量相同;CH3COOH为弱电解质,存在电离平衡,相同pH时,醋酸溶液浓度大于氢离子浓度,即醋酸的浓度大于H2SO4、HCl的浓度,与氢氧化钠溶液反应消耗的氢氧根离子多,据此进行解答.
解答 解:(1)等体积、等pH的H2SO4、HCl中,溶液pH相同,则c(H+)相同,滴加等浓度的氢氧化钠将它们恰好中和,消耗氢氧化钠溶液的体积相等,即:V1=V2;而CH3COOH为弱酸,等pH时,醋酸的浓度远远大于HCl、H2SO4,滴加等浓度的氢氧化钠将三者恰好中和,中和过程中弱酸会继续电离产生更多的氢离子,则醋酸消耗氢氧化钠溶液体积大,所以消耗NaOH溶液的体积关系为:V3>V2=V1,故答案为:V3>V2=V1;
(2)醋酸是弱酸存在电离平衡,加水稀释促进醋酸电离,氢离子物质的量增大,盐酸和硫酸是强酸,加水稀释时氢离子物质的量不变,所以醋酸溶液中氢离子浓度变化最小,故答案为:CH3COOH;
(3)盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,三种酸中C(HCl)=C(H+),2C(H2SO4)=C(H+),C(CH3COOH)>C(H+),所以要使氢离子浓度相等,则三种酸的物质的量浓度大小顺序是c(CH3COOH)>c(HCl)>c(H2SO4),故答案为:c(CH3COOH)>c(HCl)>c(H2SO4).
点评 本题考查了弱电解质的电离,明确酸溶液中酸的物质的量浓度和氢离子浓度的关系是解本题的关键,注意相同物质的量的氢氧化钠时需要的酸的物质的量,与酸的元数有关,为易错点.

练习册系列答案
相关题目
12.某反应过程能量变化如图所示,下列说法正确的是( )
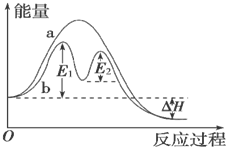

| A. | 反应过程a有催化剂参与 | |
| B. | 该反应为放热反应,热效应等于△H | |
| C. | 改变催化剂,不能改变该反应的活化能 | |
| D. | 有催化剂条件下,反应的活化能等于E1+E2 |
9.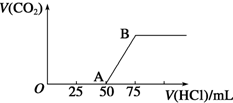 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A. | OA段所发生反应的离子方程式:H++OH-═H2O | |
| B. | NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 | |
| C. | 产生的CO2体积(标准状况下)为0.056 L | |
| D. | 原NaOH溶液的物质的量浓度为0.5 mol•L-1 |
16.常温,0.1mol/L HA酸的pH=3,现将此酸加水稀释,则溶液中随着水量的增加而减小的是( )
| A. | c(H+).c(OH-) | B. | c(H+).c(A−)c(HA)c(H+).c(A−)c(HA) | C. | c(H+) | D. | pH |
13.用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位是mol/kg.5mol/kg的硫酸的密度是1.29g/cm3,则其物质的量浓度是( )
| A. | 3.56mol/L | B. | 5.23mol/L | C. | 5.00mol/L | D. | 4.33mol/L |
10.不能使KI淀粉溶液显蓝色的物质是( )
| A. | I2 | B. | KI | C. | NO2 | D. | Cl2 |
11.把Na2SO4放入足量水中,经充分搅拌后,将所得溶液用石墨电极进行电解,阳极生成的物质是( )
| A. | H2 | B. | Ag | C. | O2 | D. | Cl2 |

 .
.