题目内容
【题目】某中学用研究性学习小组为探究碳酸钠和碳酸氢钠两种物质的某些性质、进行了如下实验,如图I~IV所示。
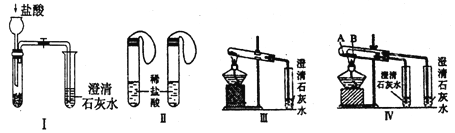
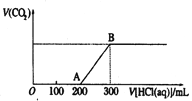
(1)若用来验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是________,发生反应的化学方程式是________。
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,除IV外还能达到实验目的的是(填装置序号)________。
(3)实验III中发生的有关离子方程式是________
(4)为测定Na2CO3和NaHCO3混合物中Na2CO3分数,采用实验III进行实验,取a克混合物充分加热,最后固体质量为b克,则碳酸钠的质量分数为________ (用含有a、b的化学式表示)。
【答案】(1)NaHCO3;2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(2)II、III。
(3)Ca2++2OH- +CO2=CaCO3↓+ H2O
(4)(84b-53a)/(31a)
【解析】
试题分析:(1)给碳酸钠直接加热,碳酸氢钠不直接加热,不直接加热的碳酸氢钠能分解而直接加热的碳酸钠不分解更能说明碳酸氢钠不稳定;当右边试管中的石灰水不变浑浊,而左边试管中的石灰水变浑浊,说明碳酸钠比碳酸氢钠稳定;分解方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(2)无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故Ⅰ无法鉴别;而Ⅱ利用等质量的碳酸钠、碳酸氢钠产生的二氧化碳的体积不同可以鉴别,Ⅲ可以通过分别加热碳酸钠、碳酸钠,根据澄清石灰水是否变浑浊鉴别、Ⅳ根据澄清石灰水是否变浑浊鉴别二者,所以能够达到实验目的是Ⅱ、Ⅲ;
(3)实验III中二氧化碳与澄清石灰水发生反应生成碳酸钙沉淀,该反应的离子方程式是:Ca2++2OH- +CO2=CaCO3↓+ H2O。
(4)加热过程中碳酸钠不变,碳酸氢钠分解,反应的方程式为:2NaHCO3![]() Na2CO3+H2O+CO2↑,反应前后固体质量变化为:bg,则:
Na2CO3+H2O+CO2↑,反应前后固体质量变化为:bg,则:
2NaHCO3![]() Na2CO3+H2O+CO2↑ 减少的固体质量△m
Na2CO3+H2O+CO2↑ 减少的固体质量△m
168 106 62
m(NaHCO3) bg
m(NaHCO3)=168b/62g=84b/31g,则碳酸钠的质量为(a-84b/31)g
则碳酸钠的质量分数为(a-84b/31)÷a=(84b-53a)/(31a)。
故答案为:(84b-53a)/(31a)。

 阅读快车系列答案
阅读快车系列答案