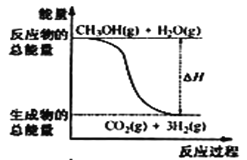
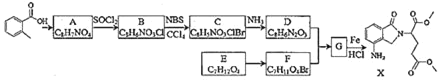
题目内容
【题目】将2molA气体和![]() 气体在固定体积的密闭容器中混合并在一定条件下发生如下反应并达到平衡状态:
气体在固定体积的密闭容器中混合并在一定条件下发生如下反应并达到平衡状态:![]()
![]() ,此反应为放热反应。下列能增大正、逆反应速率的方法是:①再充入1molA气体;②充入2mol的惰性气体;③加入正催化剂;④升高温度;⑤移走部分C气体。其中正确的是
,此反应为放热反应。下列能增大正、逆反应速率的方法是:①再充入1molA气体;②充入2mol的惰性气体;③加入正催化剂;④升高温度;⑤移走部分C气体。其中正确的是
A.①③⑤B.①③④C.①②④⑤D.①②③④⑤
【答案】B
【解析】
①再充入1molA气体,反应物浓度增大,正反应速率瞬间增大,逆反应速率随之增大,故符合;
②充入2mol的惰性气体,因容器容积不变,各物质浓度不变,则正逆反应速率均不变,故不符合;
③加入正催化剂,正逆反应速率均增大,故符合;
④升高温度,正逆反应速率均增大,故符合;
⑤移走部分C气体,生成物浓度减小,逆反应速率瞬间减小,正反应速率随之减小,故不符合;
综上所述,①③④能增大正、逆反应速率,B项正确;
故选B。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。