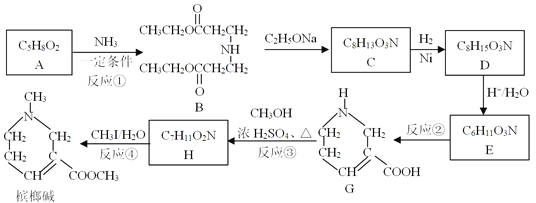
题目内容
【题目】惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有![]() [
[![]() ]、
]、![]() [
[![]() ]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
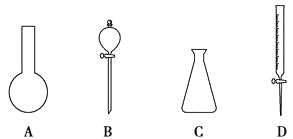
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。

(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ.mol-1) | 520 | 496 | 419 |
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。
【答案】 [Kr]4d105s25p6 B 离子键、配位键 C Li、Na、K 金属键 sp sp3 120°
【解析】(1)X位于第五周期的sp区,处于全满稳定状态,核外电子排布式为[Kr]4d105s25p6;氙原子半径大,电离能越小,越容易失去电子,化学性质越活泼,A、氙为稀有气体,含量比较少,A错误;B、氙原子半径大,电离能小,B正确;C、氙在稀有气体中原子半径较大,电离能较小,C错误,答案选B;(2)根据相似相溶原理,XePtF6不溶于CCl4等非极性溶剂,XePtF6具有较强的极性,其化学键类型为离子键和配位键;(3)金属Pt采用“…ABCABC…”型堆积方式,为立方面心结构,因此选C;(4)由铯的最外层电子排布式为6s1可知X、Y、Z为第ⅠA族,而ⅠA族前四周期的元素分别为H、Li、Na、K,又由提供的X、Y的第一电离能的差值与Y、Z的第一电离能的差值相差不大可知,X、Y、Z不可能有H元素,而同主族元素随着电子层数的增加,第一电离能逐渐减小,故X、Y、Z分别为Li、Na、K;都是金属单质,微粒均以金属键结合;(5)BeF2分子内中心原子为Be,其价电子数为2,F提供2个电子,所以Be原子的价层电子对数为(2+2)/2=2,Be原子的杂化类型为sp杂化;H2O分子的中心原子为O,其价电子数为6,H提供2个电子,所以O原子的价层电子对数为(6+2)/2=4,O原子杂化类型为sp3;(6)硼原子价电子数为3,Cl提供3个电子,硼原子的价层电子对数为(3+3)/2=3,因价层电子对中没有孤对电子,故BCl3为平面正三角形结构,分子中B-Cl键的键角为120°。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案