��Ŀ����
����Ŀ��ʵ����ʹ��pH���������ⶨNa2CO3��NaHCO3�������NaHCO3�ĺ�������ȡ1.59g��Ʒ������ˮ���250.00mL��Һ��ȡ������Һ25.00mL��0.1molL��1������еζ����õ���ͼ���ߣ�����˵���������ȷ���ǣ� ��
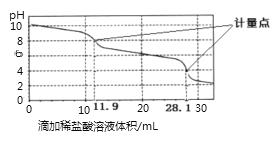
A. ��һ��������ǰ������Ӧ�����ӷ���ʽΪHCO3��+H+�TH2O+CO2��
B. ��һ����������Һ�д��ڴ�������������Cl����HCO3��
C. ����Ʒn��NaHCO3��=��28.1��2��11.9����10��4 mol
D. ʹ�ø÷����ⶨNa2CO3��NaOH�����Һ�е��������ƺ���������õ�1��������
���𰸡�C
��������A����ͼʾ����һ��������ǰ��Һ�Լ��ԣ������ķ�Ӧ��CO32�D��H��=HCO3�D����A����B����һ����������ҺPH=4�������ԣ������д�����HCO3�D���ڣ���B����C��Na2CO3��NaHCO3���������ᣬ���ȷ���CO32�D��H��=HCO3�D����ȥ����11.9mL���ٷ���HCO3�D��H��=H2O��CO2��������CO32�D��H��=HCO3�D��HCO3�D��H��=H2O��CO2�����������ĵ����������ͬ��������Ʒ��Na2CO3��������11.9mL��2������Ʒ��NaHCO3���ĵ�����Ϊ![]() ������Ʒ��
������Ʒ��![]() =��28.1��2��11.9����10��4 mol����C��ȷ��D��Na2CO3��NaOH�����Һ�м������ᣬ�����к�NaOH������Na2CO3��Ӧ������NaHCO3���������NaCl����ֹһ�������㣬Ӧ�����������㣬��D����ѡC��
=��28.1��2��11.9����10��4 mol����C��ȷ��D��Na2CO3��NaOH�����Һ�м������ᣬ�����к�NaOH������Na2CO3��Ӧ������NaHCO3���������NaCl����ֹһ�������㣬Ӧ�����������㣬��D����ѡC��

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�����Ŀ�����������������ȶ����ƣ������ſ�ѧ�ķ�չ����ѧ���Ǻϳ���һЩ믵Ļ����������ѧ֪ʶ�ش��������⣺
(1) Xeԭ�ӵĺ�������Ų�ʽΪ________��ϡ��������ֻ����ܺϳɳ����ֻ������ԭ�������_____ (����ţ���
A.믺����ȽϷḻ B.�ԭ�Ӱ뾶������С C.�ԭ�Ӱ뾶С�������ܴ�
(2) �о�����ָ����������XePtF6�Ļ��ϼ���![]() [
[![]() ]��
]��![]() [
[![]() ]���ֿ��ܣ���֤ʵXePtF6������CC14�ȷǼ����ܼ������ݴ˿�ȷ��Xe[PtF6]�л�ѧ������Ϊ_____________��
]���ֿ��ܣ���֤ʵXePtF6������CC14�ȷǼ����ܼ������ݴ˿�ȷ��Xe[PtF6]�л�ѧ������Ϊ_____________��
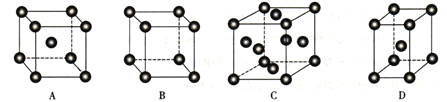
(3)����Pt���á���ABCABC�����Ͷѻ���ʽ�����һ������������ȷ����__________ (����ţ���
(4)��֪���ͬ�����ǰ�����ڣ������������ڣ�������Ԫ��X��Y��Z�ĵ��������±�:
Ԫ�ش��� | X | Y | Z |
��һ�����ܣ�kJ.mol-1) | 520 | 496 | 419 |
��ô����Ԫ��X��Y��Z��Ԫ�ط��ŷֱ�Ϊ__________���γ��䵥�ʾ���Ļ�ѧ��������____________��
(5)��Ԫ�����Ԫ��ͬ���壬BeF2��H2O����������ԭ�ӹ��ɵĹ��ۻ�������ӣ����߷����е�����ԭ��Be��O���ӻ���ʽ�ֱ���___________��__________________��
(6)���ͬ������Ⱦ��нϸߵĻ����ԣ��ܹ��γɴ����ĺ��Ȼ����������Ȼ���ǽ����Ȼ���ȡ�BC13��һ�ַǽ����Ȼ�������ʷ�����B-Cl���ļ���Ϊ_____________��