题目内容
【题目】工业上常利用含硫废水生产Na2S2O35H2O,原理是S+Na2SO3![]() Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。
Na2S2O3(Na2SO3稍过量)。实验室可用如下装置(略去部分加持仪器)模拟生成过程。

(1)仪器A中产生气体的化学方程式为______________________。
(2)装置B的作用是________________________________________。
(3)实验中,为使SO2缓慢进入装置C,采用的操作是____________________,装置C中制备反应结束的现象是_________________________________。
(4)装置C中的溶液,一般控制在碱性环境,否则产品发黄,用离子反应方程式表示其原因________________________________________________;为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是___________________;反应结束后,过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
(5)装置D用于处理尾气,可选用的最合理装置(夹持仪器已略去)为______(填序号)。

【答案】 Na2SO3+H2SO4==Na2SO4+SO2↑+H2O 缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率 控制滴加硫酸的速度 溶液重新变为澄清 S2O32-+2H+==S↓+SO2↑+H2O 先通一段时间SO2后再打开加热装置 蒸发 d
【解析】试题分析:(1) 仪器A中亚硫酸钠与浓硫酸反应生成二氧化硫、硫酸钠、水;(2)装置B的作用是可以通过观察气泡,分析生成二氧化硫的速率,通过观察长颈漏斗内液面的变化判断装置内的压强变化;(3)实验中,可以通过控制滴加硫酸的速度使SO2缓慢进入装置C;C中发生如下3个反应,
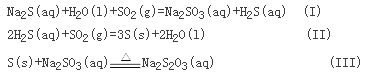 反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应所以烧瓶C中反应达到终点的现象是溶液变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气;溶液蒸发、结晶、过滤、洗涤、干燥可得产品;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收,A装置。
反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应所以烧瓶C中反应达到终点的现象是溶液变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气;溶液蒸发、结晶、过滤、洗涤、干燥可得产品;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收,A装置。
解析:根据以上分析,(1) 仪器A中亚硫酸钠与浓硫酸反应的方程式为Na2SO3+H2SO4==Na2SO4+SO2↑+H2O;
(2)装置B的作用是可以通过观察气泡,分析生成二氧化硫的速率,通过观察长颈漏斗内液面的变化判断装置内的压强变化,所以仪器B的作用是缓冲装置(或者平衡装置内外压强等)、观察SO2生成速率;
(3)实验中,可以通过控制滴加硫酸的速度使SO2缓慢进入装置C;
C中发生如下3个反应,
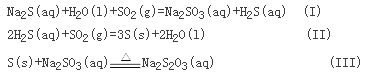
反应(III)相对较慢,而反应III是固体S与亚硫酸钠溶液反应,所以烧瓶C中反应达到终点的现象是溶液重新变澄清。(4)Na2S2O3在酸性条件下不稳定,生成硫、二氧化硫,方程式为S2O32-+2H+==S↓+SO2↑+H2O ;Na2SO3容易被氧气氧化为Na2SO4,为减少装置C中常可能出现的Na2SO4杂质,需要隔绝空气,方法是先通一段时间SO2后再打开加热装置;溶液蒸发可以获得晶体;(5)尾气中含有二氧化硫,可以氢氧化钠等碱性溶液吸收。A装置由于有橡胶塞,二氧化硫不能进入,故A错误;液体试剂不能放入U型管中,故B错误;二氧化硫难溶于硫酸,故C错误;二氧化硫易溶于氢氧化钠溶液,并且有防倒吸装置,故d正确。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】惰性气体以性质稳定著称,但随着科学的发展,科学家们合成了一些氙的化合物。根据所学知识回答下列问题:
(1) Xe原子的核外电子排布式为________。稀有气体中只有氙能合成出多种化合物,其原因可能是_____ (填序号)。
A.氙含量比较丰富 B.氙原子半径大,电离能小 C.氙原子半径小,电离能大
(2) 研究报告指出:“关于XePtF6的化合价有![]() [
[![]() ]、
]、![]() [
[![]() ]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
]两种可能,经证实XePtF6不溶于CC14等非极性溶剂。”据此可确定Xe[PtF6]中化学键类型为_____________。
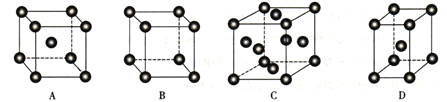
(3)金属Pt采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是__________ (填序号)。
(4)已知与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的电离能如下表:
元素代号 | X | Y | Z |
第一电离能(kJ.mol-1) | 520 | 496 | 419 |
那么三种元素X、Y、Z的元素符号分别为__________,形成其单质晶体的化学键类型是____________。
(5)氟元素与碘元素同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,两者分子中的中心原子Be和O的杂化方式分别是___________、__________________。
(6)与碘同主族的氯具有较高的活泼性,能够形成大量的含氯化合物,如金属氯化物、非金属氯化物等。BC13是一种非金属氯化物,该物质分子中B-Cl键的键角为_____________。


