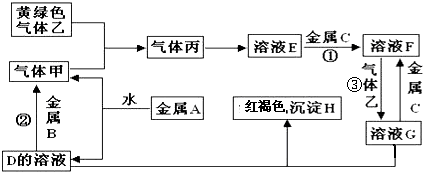
题目内容
11.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.160 | 0.102 | 0.074 |
| 主要化合价 | +1 | +2 | -2、+4、+6 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | X和W能组成两种化合物 | |
| C. | Y和W属于同周期的元素 | |
| D. | Z和W属于同主族元素,其单质能直接化合生成ZW3 |
分析 短周期元素中,Z、W均有-2价,Z有+6价且Z的原子半径较大,故Z为S元素、W为O元素;X化合价为+1价,应为周期表第IA族,Y的化合价为+2价,应为周期表第ⅡA族元素,原子半径X>Y>S,故X为Na、Y为Mg,结合元素周期律与盐酸化合物性质解答.
解答 解:短周期元素中,Z、W均有-2价,Z有+6价且Z的原子半径较大,故Z为S元素、W为O元素;X化合价为+1价,应为周期表第IA族,Y的化合价为+2价,应为周期表第ⅡA族元素,原子半径X>Y>S,故X为Na、Y为Mg.
A.同周期自左而右金属性减弱,故金属性Na>Mg,故A错误;
B.X和W能组成氧化钠、过氧化钠两种化合物,故B正确;
C.Y为Mg、W为O,二者分别处于第三、第二周期,不是属于同周期元素,故C错误;
D.Z和W属于同主族元素,其单质能直接化合生成SO2,故D错误,
故选B.
点评 本题考查元素位置结构和性质的关系及应用,关键是根据原子半径与化合价推断元素,注意对元素周期律的理解掌握.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
1.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1molCH4分子中共价键总数为4NA | |
| B. | 18gD2O中含有的质子数目为10NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 28gN2和1molCH2=CH2所含电子数都是14NA |
2.下列有关化学用语使用正确的是( )
| A. | 乙醇分子比例模型: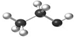 | |
| B. | 醛基的电子式: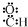 | |
| C. | 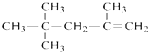 的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 | |
| D. | 乙酸、葡萄糖、淀粉的最简式均为CH2O |
19.氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2+O2═2H2O,其中一个电极反应为:O2+2H2O+4e-═4OH-.下列叙述正确的是( )
| A. | H2通入负极区 | B. | O2通入负极区 | ||
| C. | 负极反应为2H2-4e-═4H+ | D. | 溶液中OH-由正极向负极移动 |
6.北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60实验测知该物质属于离子化合物,且有良好的超导性,下列关于K3C60的组成和结构的分析正确的是( )
| A. | K3C60中既有离子键,又有极性共价键 | |
| B. | 该物质在熔融状态下能导电 | |
| C. | 该物质的化学式可写成KC20 | |
| D. | 1molK3C60中含有的共价键的数目约为60×6.02×1023个 |
3.下列烷烃的系统命名中,不正确的是( )
| A. | 2,3-二甲基戊烷 | B. | 2,2,3-三甲基丁烷 | ||
| C. | 3,3-二甲基丁烷 | D. | 3-甲基-2-乙基戊烷 |
20.为解决日益加剧的温室效应等问题,科学家正在研究建立如图所示的二氧化碳新循环体系:上述关系图能反映的化学观点或化学思想有( )
①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能和光能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的.
①二氧化碳也是一种重要的资源;
②光能或电能可以转化为化学能;
③燃烧时化学能可以转化为热能和光能;
④无机物和有机物可以相互转化;
⑤化学变化中元素种类是守恒的.

| A. | ①②③ | B. | ①④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
1.蛇文石矿可以看作是由MgO、Fe2O3、Al2O3、SiO2组成.由蛇文石制取碱式碳酸镁的实验步骤如下:

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
Ca(OH)2不能过量,若Ca(OH)2过量会导致Al(OH)3溶解、生成Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)

(1)蛇文石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是Fe3+、Al3+.
(2)进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
(3)从沉淀混合物A中提取红色氧化物做颜料,先向沉淀物A中加入NaOH或Ca(OH)2(填物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
(4)物质循环使用可节约能源.上述实验中,可以循环使用的物质是碳酸钙或二氧化碳(填写物质的名称).
(5)设计一个实验,确定产品a MgCO3•b Mg(OH)2•cH2O中的a、b、c的值.将32.8g产品完全分解后,产生13.2g CO2和16.0g MgO.由此可知,产品的化学式中a:b:c=3:1:3.(填最简整数比)