题目内容
【题目】某实验小组进行氯气性质的实验探究,设计了如图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。请回答相关问题:

(1)A中放置固体二氧化锰的装置名称是_________。
(2)制备实验开始时,先检查装置气密性,如何检查整套装置的气密性?_____________________________________________________________。
(3)检查完装置的气密性后,接下来的操作依次是________(填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(4)写出A中反应的化学方程式________________________________。
(5)装置B的作用是______________________________________________。
(6)硬质玻璃管C中事先装有两个蘸有相关试剂的棉球,左侧棉球的实验现象为________________;产生该现象的原因可能是: _______________________________________________________________________。
【答案】圆底烧瓶 如图连接好装置,关闭分液漏斗的活塞,将导管末端插入水面下,微热烧瓶,导管末端有气泡冒出,冷却后,导管末端形成一段稳定的水柱。 A、C、B ![]() 吸收氯气中的HCl气体 棉花红色褪去 可能是氯气与水反应生成的酸与氢氧化钠发生中和反应,将氢氧化钠消耗完所致。也可能是氯气与水反应生成的次氯酸的强氧化性,使红色褪去。
吸收氯气中的HCl气体 棉花红色褪去 可能是氯气与水反应生成的酸与氢氧化钠发生中和反应,将氢氧化钠消耗完所致。也可能是氯气与水反应生成的次氯酸的强氧化性,使红色褪去。
【解析】
根据氯气制备原理及性质分析装置中仪器名称、实验操作方法;根据反应原理书写离子方程式;根据氯气的性质分析装置中可能的实验现象。
(1)装置A是制备氯气的发生装置,二氧化锰为固体和滴入的盐酸加热反应生成氯气,盛放二氧化锰的仪器为圆底烧瓶,故答案为:圆底烧瓶;
(2)可以根据气压变化的原理来检查气密性,故答案为:如图连接好装置,关闭分液漏斗的活塞,将导管末端插入水面下,微热烧瓶,导管末端有气泡冒出,冷却后,导管末端形成一段稳定的水柱;
(3)根据反应原理分析得先向烧瓶中加入MnO2粉末,再加浓盐酸,然后加热,故答案为:A、C、B;
(4)A中是二氧化锰和浓盐酸在加热条件下生成氯气的反应,反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)生成的氯气含有水蒸气和氯化氢,氯化氢极易溶于水,氯化钠溶液中氯离子抑制氯气和水的反应,通过饱和食盐水除去氯化氢气体杂质,故答案为:除去氯气中的氯化氢;
(6)酚酞遇碱变红,所以左侧棉花为红色,当氯气通过时的现象为棉花红色褪去;可能原因是:可能是氯气与水反应生成的酸与氢氧化钠发生中和反应,将氢氧化钠消耗完所致。也可能是氯气与水反应生成的次氯酸的强氧化性,使红色褪去,故答案为:棉花红色褪去;可能是氯气与水反应生成的酸与氢氧化钠发生中和反应,将氢氧化钠消耗完所致。也可能是氯气与水反应生成的次氯酸的强氧化性,使红色褪去。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.

①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
I.CO+2H2![]() CH3OH II.CO2+3H2
CH3OH II.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)直接甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
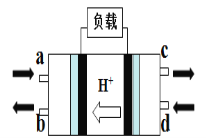
①c处产生的气体是________
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。

①乙中B极的电极反应式_______;
②乙中A极析出的气体在标况下的体积________;
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则③线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____ml 5mol/L NaOH溶液。




