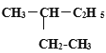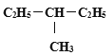题目内容
【题目】下列指定反应的离子方程式正确的是
A. Ag2SO4固体与饱和NaCl溶液反应:Ag2SO4+2Cl-=2AgCl+SO42-
B. 用惰性电极电解饱和NH4Cl溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. KMnO4酸性溶液与FeSO4溶液反应:MnO4-+Fe2++8H+=Mn2++Fe3++4H2O
【答案】A
【解析】
A.根据沉淀溶解平衡分析;
B.根据离子放电顺序,结合电解质强弱判断;
C.CO2过量时产生HCO3-;
D.电荷不守恒。
A.Ag2SO4固体在溶液中存在沉淀溶解平衡:Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq),向其水溶液中加入饱和NaCl,由于c(Ag+)·c(Cl-)>Ksp(AgCl),所以会发生反应Ag++Cl-=AgCl↓,使Ag2SO4不断溶解,最终Ag2SO4沉淀完全转化为AgCl沉淀,反应的方程式为:Ag2SO4+2Cl-=2AgCl+SO42-,A正确;
2Ag+(aq)+SO42-(aq),向其水溶液中加入饱和NaCl,由于c(Ag+)·c(Cl-)>Ksp(AgCl),所以会发生反应Ag++Cl-=AgCl↓,使Ag2SO4不断溶解,最终Ag2SO4沉淀完全转化为AgCl沉淀,反应的方程式为:Ag2SO4+2Cl-=2AgCl+SO42-,A正确;
B.用惰性电极电解饱和NH4Cl溶液,由于离子放电顺序,Cl->OH-,所以阳极发生反应:2Cl--2e-=Cl2↑,溶液中的阳离子H+在阴极放电产生H2,溶液中产生的OH-与NH4+会结合形成NH3·H2O,因此反应的离子方程式为:2NH4++2Cl-+2H2O![]() H2↑+Cl2↑+2OH-+2NH3·H2O,B错误;
H2↑+Cl2↑+2OH-+2NH3·H2O,B错误;
C.向NaAlO2溶液中通入过量的CO2,反应产生氢氧化铝沉淀和HCO3-,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,C错误;
D.KMnO4酸性溶液与FeSO4溶液发生氧化还原反应,产生Fe3+、Mn2+,根据电子守恒、电荷守恒及原子守恒,可得反应方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,D错误;

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和漂白性物质 |
B | 向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定含有CO |
C | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
D | 向蔗糖中滴加浓硫酸,蔗糖变黑 | 浓硫酸有吸水性 |
A.AB.BC.CD.D