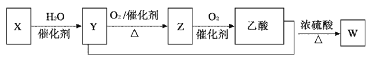
题目内容
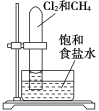
【题目】实验室常用二氧化锰与浓盐酸反应制备氯气,装置如图1所示,同时证明氯气的某些性质,装置如图2所示。按要求回答下列问题:

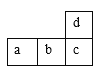
(1)制备实验开始时,先检查装置的气密性。接下来的操作依次是_____(填字母)。
a 往烧瓶中加入![]() 粉末 b 加热 c 分液漏斗中装入浓盐酸,旋开活塞往烧瓶中加入浓盐酸
粉末 b 加热 c 分液漏斗中装入浓盐酸,旋开活塞往烧瓶中加入浓盐酸
(2)写出烧瓶中反应的离子方程式___。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,甲同学提出:与足量![]() 溶液反应,称量生成的AgCl沉淀质量。方案不可行,原因是_____。
溶液反应,称量生成的AgCl沉淀质量。方案不可行,原因是_____。
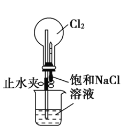
(4)图2中,浓硫酸的作用是____;试管A和B中出现的不同现象说明的事实是____。
(5)含氯气的尾气必须吸收处理,装置如图3所示。
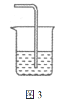
烧杯中的吸收剂可选用___(填序号)。
①饱和食盐水 ②澄清石灰水 ③饱和NaOH溶液
④饱和![]() 溶液 ⑤饱和
溶液 ⑤饱和![]() 溶液
溶液
【答案】acb MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 氯化锰和盐酸都能与硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度 干燥氯气 氯气无漂白性,次氯酸有漂白性 ③④
Mn2++Cl2↑+2H2O 氯化锰和盐酸都能与硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度 干燥氯气 氯气无漂白性,次氯酸有漂白性 ③④
【解析】
(1)依据仪器的名称和用途解答,检查气密性后先向烧瓶中加入二氧化锰再用分液漏斗加入浓盐酸加热反应制取氯气;
(2)浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,
(3)二氧化锰与浓盐酸反应生成氯化锰,氯化锰也会与硝酸银反应,所以方案不可行;
(4)浓硫酸有吸水性,可以干燥氯气;依据干燥的有色布条不褪色,湿润的有色布条褪色,对比说明具有漂白性的不是氯气;
(5)氯气在饱和食盐水中溶解度较低,澄清石灰水浓度低,饱和亚硫酸钠溶液容易和氯气反应生成二氧化硫,所以都不适合作为氯气的吸收剂。
(1)实验室用浓盐酸与二氧化锰反应制备氯气,浓盐酸放在分液漏斗中,制备实验开始时,先检查装置气密性,后先向烧瓶中加入二氧化锰再用分液漏斗加入浓盐酸加热反应制取氯气;故答案为:acb;
(2)浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)氯化锰和盐酸都能与硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度;故答案为:氯化锰和盐酸都能与硝酸银反应生成氯化银沉淀,称量生成的AgCl质量,只能求出氯离子的量,而不能求出剩余盐酸的浓度;
(4)浓硫酸有吸水性,可以干燥氯气;干燥的有色布条不褪色,湿润的有色布条褪色,说明具有漂白性的不是氯气,而是次氯酸,故答案为:干燥氯气;氯气无漂白性,次氯酸有漂白性;
(5)氯气在饱和食盐水中溶解度较低,澄清石灰水浓度低,饱和亚硫酸钠溶液容易和氯气反应生成二氧化硫,所以都不适合作为氯气的吸收剂,饱和NaOH溶液与饱和碳酸钠溶液都能与氯气反应,且产物不污染空气,所以可以用来吸收氯气;故答案为:③④。

【题目】下述实验方案中均使用了NaCl溶液,能达到实验目的的是( )
编号 | A | B | C | D |
实验 方案 |
置于光亮处 |
|
片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
|
实验 目的 | 验证甲烷与氯气发生化学反应 | 进行喷泉实验 | 验证Fe电极被保护 | 验证乙炔的还原性 |
A.AB.BC.CD.D
【题目】下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | C | N | O | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)单质化学性质最不活泼的是___;
(2)地壳中含量最多的元素是___(填名称);
(3)单质常用作半导体材料的是___;
(4)Mg原子结构示意图为___;
(5)O和S中,原子半径较大的是___;
(6)CH4和NH3中,热稳定性较强的是___(填名称);
(7)新制氯水有漂白作用,是因为其中含有___(填“HCl”或“HClO”);
(8)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),两性氢氧化物是___;
(9)某烃分子中含有6个碳原子,结构简式为![]() ,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)
,常用作有机溶剂。该有机物分子式为___,其中碳元素与氢元素的质量比m(C):m(H)=___(相对原子质量:H-1 C-12)