题目内容
【题目】某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O)

(1)b处的实验现象为___,d处的实验现象为_____。
(2)C处发生的离子方程式为____,其过程中包括___个平衡,通氯气对自来水进行杀菌消毒时,起主要作用的微粒是____。此微粒对水的电离平衡起到___“填促进”或“抑制”)作用。
(3)通过上述实验现象不能比较FeCl3与Br2氧化性的强弱,请设计实验比较两微粒氧化性的大小,并按要求回答下列问题:取___于试管中,滴加____,若溶液有____现象,说明___>___。
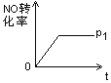
(4)二氧化氯(ClO2)在水处理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示。则pH=8时,ClO2被还原为____。

(5)亚氯酸根离子(ClO2-)对人体不利,欲在弱碱性条件下将水中的ClO2-转化为Cl-除去。若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出并配平有关化学方程式,并标出电子转移的方向和数目:_____。ClO2更适合用于饮用水的消毒,其原因是____。
【答案】黄色到橙色 溶液红色消失 Cl2+H2O![]() H++Cl-+HClO 3 HClO 抑制 取滴有KSCN的FeCl2溶液 溴水 颜色变成血红色 Br2 Fe3+ ClO2-
H++Cl-+HClO 3 HClO 抑制 取滴有KSCN的FeCl2溶液 溴水 颜色变成血红色 Br2 Fe3+ ClO2- 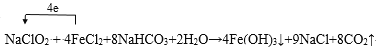 它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物
它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物
【解析】
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,生成的氯气具有氧化性;
(1)b处是发生了反应Cl2+2Br-=2Cl-+Br2,反应的实验现象为溶液变为橙色,d处氢氧化钠的酚酞溶液为红色溶液,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,Cl2+2NaOH=NaCl+NaClO+H2O,氢氧根离子消耗溶液红色褪去;
(2)c处发生的反应是氯气和水反应生成了盐酸和次氯酸,反应的离子方程式为:Cl2+H2O![]() H++Cl-+HClO,试纸变红色后褪色,过程中包含水的电离平衡,氯气和水的反应的化学平衡、次氯酸的电离平衡,通氯气对自来水进行杀菌消毒时利用的是次氯酸的强氧化性,起主要作用的微粒是HClO,次氯酸属于弱酸抑制水的电离;
H++Cl-+HClO,试纸变红色后褪色,过程中包含水的电离平衡,氯气和水的反应的化学平衡、次氯酸的电离平衡,通氯气对自来水进行杀菌消毒时利用的是次氯酸的强氧化性,起主要作用的微粒是HClO,次氯酸属于弱酸抑制水的电离;
(3)比较FeCl3与Br2氧化性的强弱,利用氧化还原反应中氧化剂氧化性大于氧化产物设计,亚铁离子在KSCN溶液中不变色,铁离子遇到KSCN溶液变血红色,取滴有KSCN的氯化亚铁溶液于试管中,滴加溴水,若溶液有溶液颜色变为血红色的现象,说明溴单质氧化性大于铁离子,反应的离子方程式为:2Fe2++Br2=2Br-+2Fe3+,氧化还原反应中氧化剂的氧化性大于氧化产物;
(4)根据图中的信息:当pH=8时,ClO2被还原为ClO2-;
(5)在弱碱性条件下水中的ClO2-转化为Cl-,体现氧化性,该反应体系中的物质NaClO2具有氧化性,FeCl2具有还原性,反应为:NaClO2+NaHCO3+FeCl2+H2O→Fe(OH)3+NaCl+CO2↑,该氧化还原反应中,Cl元素得到电子,Fe元素失去电子,化合价升高值=化合价降低值=转移电子数为4,NaClO2+4FeCl2+8NaHCO3+2H2O=4Fe(OH)3↓+9NaCl+8CO2↑,电子转移表示为: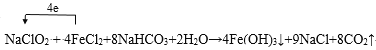 。根据以上分析可知ClO2更适合用于饮用水的消毒,其原因是:它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
。根据以上分析可知ClO2更适合用于饮用水的消毒,其原因是:它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。