题目内容
(15分)现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是______;元素F在周期表中的位置______。
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为_____,其固体时的晶体类型是______。
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4气态分子。C4分子结构如图所示,已知断裂1molC—C吸收167kJ的热量,生成1mol C≡C放出942kJ热量。试写出由C4气态分子变成C2气态分子的热化学方程式:____________。

(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分步水解而呈弱酸性。
①盐 显酸性原因(用离子方程式表示)____________。
显酸性原因(用离子方程式表示)____________。
②写出足量金属镁加入盐 的溶液中产生H2的化学方程式___________。
的溶液中产生H2的化学方程式___________。
【答案】
每空2分共15分
(1)N 第三周期 ⅦA
(2)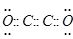 分子晶体
分子晶体
(3) =
=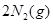
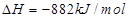 (3分)
(3分)
 (4)①N2H62++H2O N2H5·H2O++H+
(4)①N2H62++H2O N2H5·H2O++H+
② 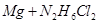 =
=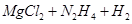
或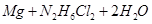 =
=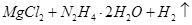
【解析】

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.






