题目内容
12.合成导电高分子材料PPV的反应: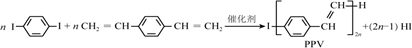
下列说法正确的是( )
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
分析 A.缩聚反应,是一类有机化学反应,是具有两个或两个以上官能团的单体,相互反应生成高分子化合物,同时产生有简单分子(如 H2O、HX、醇等)的化学反应;
B.聚苯乙烯的重复结构单元为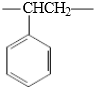 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键;
C.同系物所含官能团数目相同;
D.质谱仪能记录分子离子、碎片离子的相对质量.
解答 解:A.合成PPV通过缩聚反应生成,同时有小分子物质HI生成,不属于加聚反应,故A错误;
B.聚苯乙烯的重复结构单元为 ,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
,不含碳碳双键,而该高聚物的结构单元中含有碳碳双键,所以不相同,故B错误;
C. 有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
有两个碳碳双键,而苯乙烯有一个碳碳双键,结构不同,二者不是同系物,故C错误;
D.质谱仪能记录分子离子、碎片离子的相对质量,质谱图中数值最大的即是该分子的相对分子质量,故D正确.
故选D.
点评 本题主要考查聚合反应原理、有机物结构与性质,题目难度不大,注意明确聚合反应原理,选项B为易错点,找准链节是解题的关键.

练习册系列答案
相关题目
2.当乙烯和甲烷的混合气体完全通过盛有溴的四氯化碳溶液的洗气瓶时,洗气瓶的质量增加了14g,则生成的1,2-二溴乙烷(每个碳原子上都有一个溴原子)的质量是( )
| A. | 14g | B. | 47g | C. | 54g | D. | 94g |
3.甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,下列判断正确的是( )
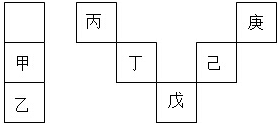

| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
20.甲醇既是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
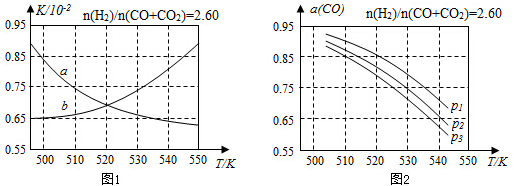
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
(2)反应①的化学平衡常数K的表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.图2中的压强由大到小为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高

1.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表.下列判断不正确的是( )
 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b<318.2 | |
| D. | 不同温度时,蔗糖浓度减少一半所需的时间相同 |
19.下列实验过程中,始终无明显现象的是( )
| A. | Cl2通入Na2CO3溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | NH3通入AgNO3溶液中 | D. | SO2通入NaHS溶液中 |
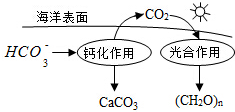
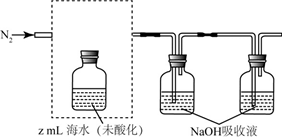
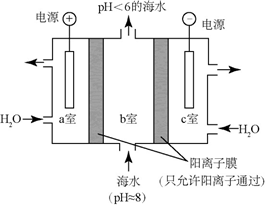
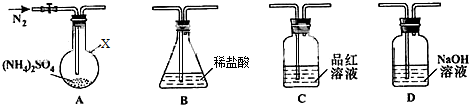
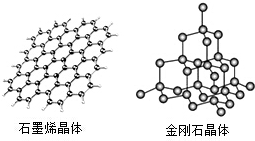 碳及其化合物广泛存在于自然界中,回答下列问题:
碳及其化合物广泛存在于自然界中,回答下列问题: