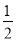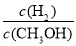题目内容
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
ΔH1=+49.0 kJ/mol;
②CH3OH(g)+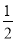 O2(g)=CO2(g)+2H2(g)
O2(g)=CO2(g)+2H2(g)
ΔH2=-192.9 kJ/mol。
根据上述反应,下列说法正确的是( )
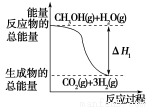
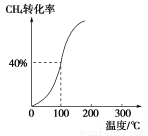
A.反应①中的能量变化如上图所示
B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)=2H2O(g) ΔH=-483.8 kJ/mol
D
【解析】A项,反应①为吸热反应,即图示能量变化关系错误;B项,从题中反应①②来看,CH3OH转变成H2可能吸热,也可能放热;反应②中生成物H2可以继续燃烧,即1 mol CH3OH充分燃烧放出的热量要大于192.9 kJ;根据盖斯定律可判断D项正确。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目