题目内容
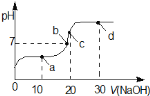
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
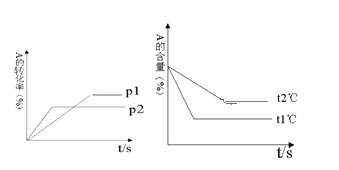
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
【答案】p1<p2 (a +b)<(c +d) t1℃>t2℃ 吸热
【解析】
根据“先拐先平”判断:p2>p1,t1>t2。p2>p1,增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动;t1>t2,温度升高,A的百分含量减小,说明平衡正向移动,△H>0。
(1)由图像可知时p2先达到平衡,说明p2压强较大,反应速率较大,则压强 p1比p2小,故答案为:p1<p2;
(2)增大压强,A的转化率减小,说明增大压强平衡向逆反应方向移动,则(a+b)比(c+d)小,故答案为:a +b<c +d;
(3)由图象可知t1℃时先达到平衡,温度较高,则温度t1℃比t2℃高,故答案为:t1℃>t2℃;
(4)温度升高,A的百分含量减小,说明平衡正向移动,升高温度,平衡向吸热反应方向移动,故答案为:吸热。

 阅读快车系列答案
阅读快车系列答案【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)