题目内容
【题目】甲醇是一种重要的工业原料,利用甲醇可以制氢气.
Ⅰ.甲醇与水蒸气反应可以直接制得氢气.
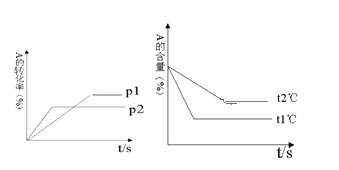
已知CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
CO2(g)+3H2(g)△H>0,一定条件下,向体积为2L的恒容器密闭容器中充入1.2molCH3OH(g)和2.8molH2O(g),实验测得,反应共吸收的能量和甲醇的体积分数随时间变化的曲线图象如图1.
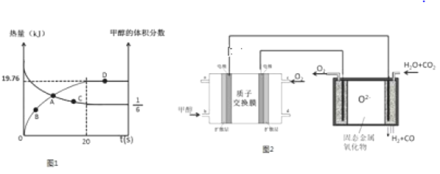
(1)从反应开始至平衡,H2的平均反应速率为___________.
(2)该条件下,CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
CO2(g)+3H2(g)的△H=__________,该反应的平衡常数为__________.
(3)在D点时,将容器的体积压缩为原来的一半,同时再充入7.2mol的H2O(g),CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
CO2(g)+3H2(g)平衡_________________移动(填“往左”、“往右”或“不”).
Ⅱ.将甲醇燃料电池高温电解等物质的量的H2O﹣CO2混合气体可以间接制备H2.其基本原理如图2所示.
(4)甲醇燃料电池以酸性溶液为电解质,写出电池负极的电极反应式_________.
(5)电解池中发生的总反应方程式为_________________.
(6)当质子交换膜中通过的H+数目为4.816×1023时,理论上电解池中产生的H2为_______________L(标准状况).
【答案】0.03mol/(L·s) +49.4kJ/mol 0.09(mol/L)2 不 CH3OH+H2O﹣6e﹣=CO2+6H+ H2O+CO2![]() H2+CO+O2 4.48
H2+CO+O2 4.48
【解析】
(1)通过三段式求取浓度变化,再根据![]() 计算;
计算;
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量;化学平衡常数![]() ;
;
(3))根据浓度商与化学平衡常数相对大小确定反应方向,如果浓度商等于平衡常数,则平衡不移动;
(4)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应;
(5)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气;
(6)串联电路中转移电子相等,根据转移电子相等计算生成氢气体积.
反应前c(CH3OH)=1.2mol/2L=0.6mol/L、c(H2O)=2.8mol/L=1.4mol/L,设参加反应的c(CH3OH)为xmol/L,列三段式:
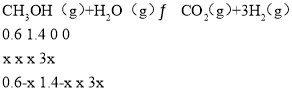
根据图知,反应后甲醇的体积分数占1/6,相同条件下体积之比等于其物质的量之比,所以甲醇的物质的量分数=![]() ,x=0.2则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,故v(H2)=0.6mol/20s=0.03mol/(L·s);
,x=0.2则生成c(H2)=3x=3×0.2mol/L=0.6mol/L,故v(H2)=0.6mol/20s=0.03mol/(L·s);
(2)参加反应的n(CH3OH)=0.2mol/L×2L=0.4mol,有0.4mol甲醇反应吸收19.76kJ热量,据此计算1mol甲醇反应吸收的热量=19.76kJ/0.4mol=+49.4kJ/mol;化学平衡常数![]() =0.09(mol/L)2;故答案为:+49.4kJ/mol;0.09(mol/L)2;
=0.09(mol/L)2;故答案为:+49.4kJ/mol;0.09(mol/L)2;
(3)再充入7.2mol水蒸气,c(H2O)=7.2mol/1L==7.2mol/L,缩小容器体积时,c(CH3OH)=0.8mol/L、c(H2O)=9.6mol/L、c(CO2)=0.4mol/L、c(H2)=1.2mol/L,浓度商=![]() ,其浓度商等于化学平衡常数,所以平衡不移动,故答案为:不;
,其浓度商等于化学平衡常数,所以平衡不移动,故答案为:不;
(4)甲醇燃料酸性电池中,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+;
(5)电解池中,反应物是水和二氧化碳,生成物是氢气、CO和氧气,故答案为:![]() ;
;
(6)串联电路中转移电子相等,正极反应式为O2+4e-+4H+=2H2O,通过离子交换膜的氢离子是4,当质子交换膜中通过的H+数目为4.816×1023时,即通过的氢离子物质的量=0.8mol,转移0.8mol电子得到0.8mol电子,根据转移电子相等得生成氢气体积=(0.8mol/4)×1×22.4L/mol=4.48L,故答案为:4.48。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案