题目内容
【题目】下列各组热化学方程式中ΔH1小于ΔH2的是
(1)S(s)+O2(g)===SO2(g),ΔH1
S(g)+O2(g)===SO2(g),ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l),ΔH1
CH4(g)+1.5O2(g)===CO(g)+2H2O(g),ΔH2
(3)4Al(s)+3O2(g)===2Al2O3(s),ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s),ΔH2
(4)放热反应CO(g)+2H2(g)![]() CH3OH(g)ΔH1
CH3OH(g)ΔH1
CO(g)+2H2(g)![]() CH3OH(l)ΔH2
CH3OH(l)ΔH2
A.只有(2) B.只有(2 ) (4)
C.只有(1) (2 ) (4) D.只有(2 ) (3)
【答案】D
【解析】
试题分析:(1) 物质的燃烧反应是放热的,焓变是负值,由固态S转变为气态S需吸收热量,故ΔH1﹥ΔH2;(2)物质的燃烧反应是放热的,焓变是负值,液态水变为气态水的过程是吸热的,且CH4燃烧生成CO是不完全反应,放出的热量比完全燃烧生成CO2放出的热量少,故ΔH1<ΔH2;(3)依据盖斯定律,由题目所给方程式相减可得4Al(s)+2Fe2O3(s)=4Fe(s)+2Al2O3(s) ΔH=ΔH1-ΔH2。所得反应为铝热反应,是放热反应,故ΔH1-ΔH2<0,ΔH1<ΔH2;(4)气态CH3OH转化为液体CH3OH是放热的,因反应放热,则有ΔH1﹥ΔH2;故选D。

 天天练口算系列答案
天天练口算系列答案【题目】某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。
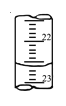
(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。