题目内容
【题目】多种短周期非金属元素的气态氧化物常会造成一些环境污染问题,化学工作者设计出将工业废气中污染物再利用的方案,以消除这些不利影响。
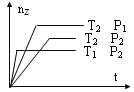
(1)以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:
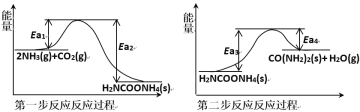
写出以氨气和二氧化碳气体为原料合成尿素的热化学方程式_________,已知两步反应中第二步反应是生产尿素的决速步骤,可判断Ea1_____Ea3(填“>”、“<”或“=”)。
(2)向体积为2 L的恒温恒容容器中通入2 mol CO和2 mol SO2,发生反应2CO(g)+SO2(g)![]() 2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
2CO2(g)+S(s)。若反应进行到10 min时达平衡,测得CO2的体积分数为0.5,则前16 min的平均反应速率v(CO)=____,该温度下反应化学平衡常数K=____。
(3)利用“亚硫酸盐法”吸收工业废气中的SO2。

①室温条件下,将工业废气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图所示,b点溶液中n(![]() )∶n(
)∶n(![]() )=________。
)=________。
②已知室温条件下,Ka1(H2SO3) =1.5×10-2;Ka2(H2SO3) =1.0×10-7;Kb(NH3H2O) =1.8×10-5。室温下,0.1molL-1的(NH4)2SO3溶液中离子浓度(不考虑OH-)由大到小顺序为________。
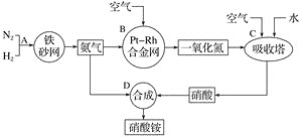
(4)利用电解烧碱和食盐的混合液,使工业废气脱氮,原理如图。
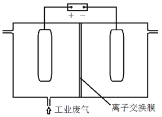
①NO被阳极产生的氧化性物质氧化为![]() 反应的离子方程式:_________________。
反应的离子方程式:_________________。
②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,该装置中应使用_______ 离子交换膜(填“阴”或“阳”)。
【答案】2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4 < 0.05 mol·L1·min1 26.7 3∶1 c(
H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4 < 0.05 mol·L1·min1 26.7 3∶1 c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+) 3Cl2+8OH-+2NO = 2
)>c(H+) 3Cl2+8OH-+2NO = 2![]() +6Cl-+4H2O 阴
+6Cl-+4H2O 阴
【解析】
(1)将第一步和第二步两步方程式相加,反应的速率主要取决于最慢的反应,最慢的反应主要是反应物活化能大。
(2)建立三段式,根据题中信息计算转化量,再计算速率和平衡常数。
(3)①根据图所示,b点溶液电荷守恒、溶液呈中性和n(![]() ) = n(
) = n(![]() );②亚硫酸根水解常数与铵根水解常数比较得出谁的水解程度占主要。
);②亚硫酸根水解常数与铵根水解常数比较得出谁的水解程度占主要。
(4)①阳极产物是氯气;②阴极水中的氢离子失去电子变为氢气,剩余氢氧根,氢氧根进入到阳极发生反应。
(1)将第一步和第二步两步方程式相加得到氨气和二氧化碳气体为原料合成尿素的热化学方程式2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4,反应的速率主要取决于最慢的反应,最慢的反应主要是反应物活化能大,已知两步反应中第二步反应是生产尿素的决速步骤,因此可判断Ea1<Ea3;故答案为:2NH3(g)+CO2(g)
H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4,反应的速率主要取决于最慢的反应,最慢的反应主要是反应物活化能大,已知两步反应中第二步反应是生产尿素的决速步骤,因此可判断Ea1<Ea3;故答案为:2NH3(g)+CO2(g)![]() H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4;<。
H2O(g)+CO(NH2)2(s) ΔH=Ea1-Ea2+Ea3-Ea4;<。
(2)若反应进行到10 min时达平衡,设转化二氧化硫物质的量为xmol,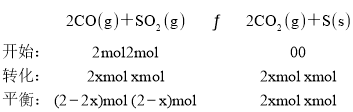 ,测得CO2的体积分数为0.5,
,测得CO2的体积分数为0.5,![]() ,解得x=0.8,则前16 min的平均反应速率
,解得x=0.8,则前16 min的平均反应速率![]() ,该温度下反应化学平衡常数
,该温度下反应化学平衡常数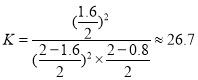 ;故答案为:0.05 mol·L1·min1;26.7。
;故答案为:0.05 mol·L1·min1;26.7。
(3)①b点溶液电荷守恒和溶液呈中性得到n(![]() )=2n(
)=2n(![]() ) + n(
) + n(![]() ),又由于n(
),又由于n(![]() ) = n(
) = n(![]() ),因此n(
),因此n(![]() )∶n(
)∶n(![]() )=3:1;故答案为:3:1。
)=3:1;故答案为:3:1。
②室温下,0.1 mol·L1的(NH4)2SO3溶液中亚硫酸根水解![]() ,铵根水解
,铵根水解![]() ,因此亚硫酸根水解占主要,溶液显碱性,亚硫酸根第一步水解为主,因此离子浓度由大到小顺序为c(
,因此亚硫酸根水解占主要,溶液显碱性,亚硫酸根第一步水解为主,因此离子浓度由大到小顺序为c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+)。
)>c(H+)。
(4)①根据放电顺序,阳极产物是氯气,NO被阳极产生的氧化性物质氧化为![]() 反应的离子方程式:3Cl2+8OH-+2NO = 2
反应的离子方程式:3Cl2+8OH-+2NO = 2![]() +6Cl-+4H2O;故答案为:3Cl2+8OH-+2NO = 2
+6Cl-+4H2O;故答案为:3Cl2+8OH-+2NO = 2![]() +6Cl-+4H2O。
+6Cl-+4H2O。
②为使该电解装置能较长时间正常工作,保持两极电解质溶液导电能力相对稳定,阴极水中的氢离子失去电子变为氢气,剩余氢氧根,氢氧根进入到阳极发生反应,因此该装置中应使用阴离子交换膜;故答案为:阴。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.0g烧碱样品。
(2)将样品配成250mL待测液。
(3)用____________(填仪器名称)量取25.00mL待测液于锥形瓶中,并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时,两眼注视____________,直到滴定终点。达到终点的具体现象是:____________。
(5)若两次实验滴定的数据如下表:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 5.00 | 28.30 |
第三次 | 25.00 | 4.00 | 24.10 |
根据上述各数据,计算烧碱的纯度:____________
(6)下列操作中,会导致所测得的烧碱的纯度偏大的是________。
a.滴定终点时,俯视刻度
b.没有用盐酸标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水