题目内容
1.下列物质中既含极性共价键又含有离子键的是( )| A. | Na2O2 | B. | KCl | C. | HCl | D. | K2SO4 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,铵根离子和酸根离子之间存在离子键,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故A错误;
B.KCl中钾离子和氯离子之间只存在离子键,故B错误;
C.HCl中H-Cl原子之间只存在极性键,故C错误;
D.硫酸钾中钾离子和硫酸根离子之间存在离子键、硫酸根离子中S-O原子之间存在极性键,故D正确;
故选D.
点评 本题考查化合物和化学键的关系,侧重考查基本概念、物质结构,明确物质的构成微粒即可判断,注意过氧化钠电子式的书写,知道离子键和共价键的区别.

练习册系列答案
相关题目
9.下列关于元素周期表的叙述正确的是( )
| A. | 同周期元素的电子层数相等 | |
| B. | 同族元素的最外层电子数一定相等 | |
| C. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
6.下列说法正确的是( )
| A. | 钠的金属性比钾强 | |
| B. | 溴的非金属性比氯强 | |
| C. | IIA族中原子半径最小的是铍 | |
| D. | 第二周期中,除稀有气体元素外原子半径最大的是锂 |
13.关于乙烯的化学性质,说法正确的是( )
| A. | 能发生聚合反应 | B. | 能使溴水褪色 | ||
| C. | 可与H2发生加成反应 | D. | 可与HCl加成 |
10.可与人体血液中的物质结合导致中毒的空气污染物是( )
| A. | NO | B. | N2 | C. | CO2 | D. | CO |
11.下列说法正确的是( )
| A. | SO2与Na2SO3或NaHCO3溶液能发生反应 | |
| B. | SO2和CO2分别通入BaCl2和Ba(NO3)2溶液中都不产生沉淀 | |
| C. | 浓硫酸具有吸水性,因而能使蔗糖碳化 | |
| D. | SO2和O2混合加热,可生成三氧化硫 |
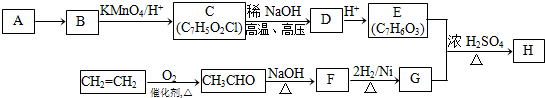
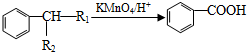 (-R1、-R2表示氢原子或烃基);
(-R1、-R2表示氢原子或烃基);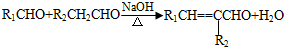 ;
;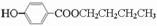 .
.
 ②
② ③
③ ④
④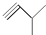 ⑤
⑤ .请按要求填空:
.请按要求填空: .
.