题目内容
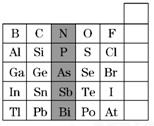
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
(1)元素Ge在元素周期表中的位置为第 周期第 族. 根据元素周期律,预测:酸性强弱 H2SiO3 H2GeO3.(用“>”或“<”表示)
(2)表中有aXm+、bZn-两种离子的电子层结构相同(a、b为元素的原子序数),则a-b= (用m、n表示),两离子的半径比较:r (aXm+) r (bZn-).
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中大量存在的三种离子是 .
(4)将某气态碳氢化合物4.48L(标况)置于密闭容器中充分燃烧后,将其产物依次经过足量的浓硫酸、碱石灰后,浓硫酸的质量增加14.4g;最后气体被碱石灰完全吸收,碱石灰质量增加35.2g,请写出该有机物的分子式 ,写出三种符合该分子式的有机物的结构简式 、 、 、 .
| C | N | O | F | |
| Si | P | S | Cl | |
| Ge | As | Se | Br | |
| Sn | Sb | Te | I | |
| Pb | Bi | Po | At |
(2)表中有aXm+、bZn-两种离子的电子层结构相同(a、b为元素的原子序数),则a-b=
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中大量存在的三种离子是
(4)将某气态碳氢化合物4.48L(标况)置于密闭容器中充分燃烧后,将其产物依次经过足量的浓硫酸、碱石灰后,浓硫酸的质量增加14.4g;最后气体被碱石灰完全吸收,碱石灰质量增加35.2g,请写出该有机物的分子式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)元素Ge在元素周期表中的位置为第四周期第IVA族,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(2)根据电子相等得a-m=b+n,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,二者发生氧化还原反应生成硫酸和氢溴酸;
(4)碳氢化合物物质的量=
=0.2mol,浓硫酸吸收水、碱石灰吸收二氧化碳,n(H2O)=
=0.8mol,n(CO2)=
=0.8mol,碳氢化合物分子数与H、C原子的个数之比=0.2mol:1.6mol:0.8mol=1:8:4,所以该分子为C4H8,该物质属于单烯烃或环烷烃.
(2)根据电子相等得a-m=b+n,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,二者发生氧化还原反应生成硫酸和氢溴酸;
(4)碳氢化合物物质的量=
| 4.48L |
| 22.4L/mol |
| 14.4g |
| 18g/mol |
| 35.2g |
| 44g/mol |
解答:
解:(1)元素Ge在元素周期表中的位置为第四周期第IVA族,非金属性Si>Ge,所以酸性强弱 H2SiO3>H2GeO3,故答案为:四;IVA;>;
(2)根据电子相等得a-m=b+n,所以a-b=m+n,所以X的原子序数大于Y,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径r(aXm+)r<(bZn-),故答案为:m+n;<;
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,二者发生氧化还原反应生成硫酸和氢溴酸,离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,所以溶液中大量存在的三种离子是H+、Br-、SO42-,故答案为:H+、Br-、SO42-;
(4)碳氢化合物物质的量=
=0.2mol,浓硫酸吸收水、碱石灰吸收二氧化碳,n(H2O)=
=0.8mol,n(CO2)=
=0.8mol,碳氢化合物分子数与H、C原子的个数之比=0.2mol:1.6mol:0.8mol=1:8:4,所以该分子为C4H8,该物质属于单烯烃或环烷烃,其结构简式分别为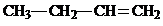 、
、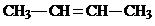 、
、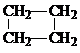 、
、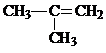 ,
,
故答案为:C4H8;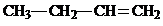 ;
;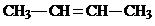 ;
;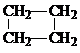 ;
;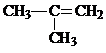 .
.
(2)根据电子相等得a-m=b+n,所以a-b=m+n,所以X的原子序数大于Y,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径r(aXm+)r<(bZn-),故答案为:m+n;<;
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,二者发生氧化还原反应生成硫酸和氢溴酸,离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,所以溶液中大量存在的三种离子是H+、Br-、SO42-,故答案为:H+、Br-、SO42-;
(4)碳氢化合物物质的量=
| 4.48L |
| 22.4L/mol |
| 14.4g |
| 18g/mol |
| 35.2g |
| 44g/mol |
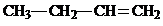 、
、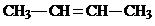 、
、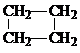 、
、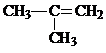 ,
,故答案为:C4H8;
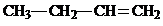 ;
;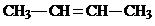 ;
;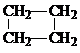 ;
;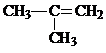 .
.
点评:本题考查了元素周期表和元素周期律的综合应用,涉及离子半径大小比较、氧化还原反应,有机物结构式的确定等知识点,根据元素周期律、物质的性质等知识点分析解答,注意基础知识的积累,题目难度不大.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O |
| D、碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
如图是元素周期表的一部分,下列说法正确的是( )

| A、阴影部分元素在周期表中处于第ⅣA族 |
| B、H3AsO4的酸性大于H3PO4 |
| C、元素铊(Tl)的最高价氧化物的水化物的碱性:Tl(OH)3<Al(OH)3 |
| D、元素砹(At)为有色固体,难与氢气化合 |