题目内容
1. 乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )
乙醇氧化制乙醛的实验装置如图所示(夹持仪器和加热仪器均未画出),下列叙述错误的是( )| A. | a中所盛的固体可以是CuO | |
| B. | d中乙醇可用沸水浴加热 | |
| C. | c处具支试管b中有无色液体产生 | |
| D. | c处具支试管b可换成带塞的普通试管 |
分析 A.乙醇和和氧化铜反应生成乙醛和水;
B.直接加热时,生成乙醇蒸汽的速率较大,乙醇和氧化铜反应不完全,为了使A中的乙醇平稳气化成蒸气,可采用水浴加热的方法;
C.乙醇和和氧化铜反应生成乙醛和水,冷凝后产生无色液体;
D.C中的试管应保持与外界相通.
解答 解:A.乙醇和和氧化铜反应生成乙醛和水,所以a中所盛的固体可以是CuO,故A正确;
B.直接加热时,生成乙醇蒸汽的速率较大,乙醇和氧化铜反应不完全,为了使a中的乙醇平稳气化成蒸气,d中乙醇可用沸水浴加热的方法,故B正确;
C.乙醇和和氧化铜反应生成乙醛和水,冷凝后c处具支试管b中有无色液体产生,故C正确;
D.C中的试管应保持与外界相通,所以C中的具支试管不可换成带塞的普通试管,故D错误;
故选D.
点评 本题主要考查了乙醇的化学性质,可以根据所学知识进行回答,明确实验的原理是解题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.次氯酸可用于杀菌消毒.已知25°C时:[①HClO(aq)+OH-(aq)=ClO-(aq)+H2O(l)△H=-Q1kJ•mol-1②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | 已知酸性H2SO3>HClO>HSO3-,则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+HClO=HSO3-+ClO- | |
| B. | 将20ml 1mol/L HClO溶液与10ml 1mol/L NaOH溶液混合后,所得的混合溶液中一定存在:2c(H+)-2c(OH-)=c(ClO-)-c(HClO) | |
| C. | 在25°C时,次氯酸的电离方程式及热效应可表示为:HClO(aq)?H+(aq)+ClO-(aq)△H=-(57.3+Q1)kJ•mol-1 | |
| D. | 已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
9. 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示.其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法不正确的是( )| A. | 放电时,电子由钙电极流出 | |
| B. | 放电过程中,Li+向PbSO4电极移动 | |
| C. | 每转移0.2mol电子,理论上生成20.7gPb | |
| D. | 负极反应式:PbSO4+2e-+2Li+═Li2SO4+Pb |
6.已知两个热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
现有0.2mol 炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C和H2的物质的量之比为( )
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
现有0.2mol 炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C和H2的物质的量之比为( )
| A. | 1:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
2.欲将蛋白质从水中析出而又不改变它的性质,可以加入( )
| A. | (NH4)2SO4溶液 | B. | 乙醇溶液 | C. | Pb(NO3)2溶液 | D. | NaOH溶液 |
19.下列各有机物的分类或命名正确的是( )
| A. | 对甲基苯酚(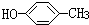 )属于芳香烃 )属于芳香烃 | B. | 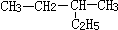 2-乙基丁烷 2-乙基丁烷 | ||
| C. | 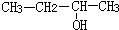 3-丁醇 3-丁醇 | D. | 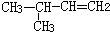 3-甲基-1-丁烯 3-甲基-1-丁烯 |
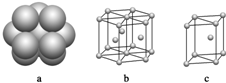 A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素.回答下列问题:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素.已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素.回答下列问题: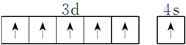 .B、C、D元素的第一电离能由大到小的顺序是N>O>C(用元素符号表示).
.B、C、D元素的第一电离能由大到小的顺序是N>O>C(用元素符号表示). 氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等.
氢气是一种理想的“绿色能源”,利用氢能需选择合适的储氢材料.目前正在研究和使用的储氢材料有镁系合金、稀土系合金等. (g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$
(g)$?_{高温}^{FeSO_{4}/Al_{2}O_{3}}$ (g)+3H2(g)
(g)+3H2(g)