题目内容
【题目】下列有关化学实验操作,现象和结论均为正确的是
选项 | 操作 | 现象 | 结论 |
A | Mg2+和Cu2+共存的溶液中滴入适量NaOH溶液 | 产生白色沉淀 | 相同温度下,溶度积常数 Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
B | 加热盛有(NH4)2CO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 试纸变蓝 | (NH4)2CO3显碱性 |
C | 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液 | 碳酸钠溶液中红色更深 | 阴离子水解常数Kh: CO32->HCO3- |
D | 向饱和硼酸溶液中滴加少量Na2CO3粉末 | 无气泡冒出 | 不能证明酸性:碳酸>硼酸 |
A.AB.BC.CD.D
【答案】C
【解析】
A.因不确定Mg2+和Cu2+的浓度,因此无法根据实验现象判断Mg(OH)2、Cu(OH)2的溶度积大小,故A错误;
B.铵盐的稳定性较差,加热(NH4)2CO3会分解产生氨气,能够使湿润的红色石蕊试纸变蓝,并不能确定(NH4)2CO3的酸碱性,故B错误;
C.Na2CO3和NaHCO3均属于强碱弱酸盐,阴离子在水中均会发生水解,相同浓度的Na2CO3和NaHCO3溶液中滴加酚酞溶液后,碳酸钠溶液中红色更深,说明其溶液中碱性较强,可说明![]() 更易发生水解,即水解常数:
更易发生水解,即水解常数:![]() >
>![]() ,故C正确;
,故C正确;
D.向饱和硼酸溶液中滴加少量Na2CO3粉末,无气泡冒出,可说明无二氧化碳生成,根据复分解反应以强制弱原则可知,酸性:碳酸>硼酸,故D错误;
故答案为:C。

 阅读快车系列答案
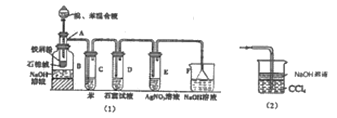
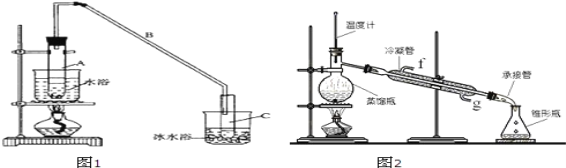
阅读快车系列答案【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯。
已知: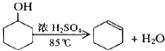
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
环乙烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____。
②试管C置于冰水浴中的目的是_____。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层。(填上或下)
②再将环己烯按图2装置蒸馏,冷却水从口进入_____(填“g”或“f”)。收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,最可能的原因是_____。
A.蒸馏时从70℃开始收集产品
B.环已醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出