题目内容
5.已知:P4(g)+6Cl2(g)=4PCl3(g).1mol P4(g)与氯气完全反应生成PCl3(g)放出a kJ的热量,P4具有正四面体结构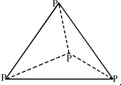 ,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )
,打破1mol P-Cl键吸收b kJ的热量,打破1mol Cl-Cl键吸收c kJ的热量.下列叙述正确的是( )| A. | 1 mol P4(g)和1 mol Cl2(g)所具有的能量和大于1 mol PCl3(g) 所具有的能量 | |
| B. | 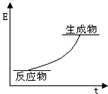 该反应的能量图象可表示 该反应的能量图象可表示 | |
| C. | 形成1mol P-P键放出-($\frac{a}{6}$-2b+c) kJ的热量 | |
| D. | 因为该反应为放热反应,故不需要任何条件就能快速进行 |
分析 A、由P4(g)+6Cl2(g)=4PCl3(g)放出a kJ的热量,说明1 mol P4(g)和6 mol Cl2(g)所具有的能量和大于4 mol PCl3(g) 所具有的能量;
B、由P4(g)+6Cl2(g)=4PCl3(g)放出a kJ的热量,说明反应物总能量大于生成物总能量;
C、根据焓变△H=反应物键能之和-生成物键能之和,计算P-P键键能;
D、有些放热反应需要加热引发才能发生.
解答 解:A、由P4(g)+6Cl2(g)=4PCl3(g)放出a kJ的热量,说明1 mol P4(g)和6 mol Cl2(g)所具有的能量和大于4 mol PCl3(g) 所具有的能量,不能说明1 molP4(g)和1mol Cl2(g)所具有的能量和大于1mol PCl3(g) 所具有的能量,故A错误;
B、由P4(g)+6Cl2(g)=4PCl3(g)放出a kJ的热量,说明反应物总能量大于生成物总能量,故B错误;
C、由P4(g)+6Cl2(g)=4PCl3(g)放出a kJ的热量,根据焓变△H=反应物键能之和-生成物键能之和,所以设P-P键键能为xKJ/mol,△H=-a=6x+6c-12b,解得x=-($\frac{a}{6}$-2b+c),所以形成1mol P-P键放出-($\frac{a}{6}$-2b+c) kJ的热量,故C正确;
D、有些放热反应需要加热引发才能发生,比如物质的燃烧,故D错误;
故选:C.
点评 本题考查了化学键与焓变定量计算关系,物质结构的分析应用以及放热反应与反应物和生成物总能量之间的关系,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列有关有机物的说法正确的是( )
| A. | (CH3CH2)2CHCH3的系统命名是2-乙基丁烷 | |
| B. | 葡萄糖在不同的条件下可以发生取代、加成、消去、氧化、还原、酯化反应 | |
| C. | 有机同系物具有相同的通式,且组成相差n个CH2,因此等质量的同系物完全燃烧耗氧相差物质的量为1.5nmol | |
| D. | 分离乙酸乙酯、乙酸、乙醇的混和物流程如下: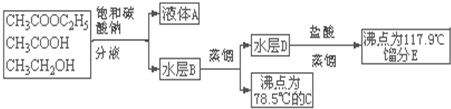 |
16.下列涉及有机物的性质或应用的说法不正确的是( )
| A. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| C. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 | |
| D. | 蛋白质和油脂都是能发生水解反应的高分子化合物 |
13.有机物A的键线式为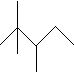 ,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )
 ,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到A,下列有关说法错误的是( )| A. | A的最简式为C4H9 | |
| B. | A的一氯代物有5种 | |
| C. | A有许多同分异构体,其中主链碳数为5有机物有5种(不包括A) | |
| D. | B的结构可能有3种,其中一种名称为:2,2,3-三甲基-3-戊烯 |
20.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 该反应中,反应物吸收环境中的热量转化为产物内部的能量 |
10.下列物质中,属于共价化合物的是( )
| A. | Cl2 | B. | NH4Cl | C. | H2O | D. | KOH |
17.下列关于元素周期表的说法正确的是( )
| A. | 每一周期的元素都从碱金属开始,最后以稀有气体结束 | |
| B. | 第二、三周期上下相邻的元素的原子核外电子数相差8个 | |
| C. | 只有第2列元素的原子最外层有2个电子 | |
| D. | 元素周期表共有十六个纵行,也就是十六个族 |
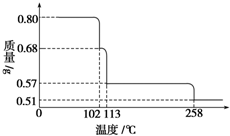 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.