题目内容
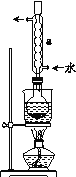
【题目】利用下列有关装置可进行多种实验,回答下列问题。

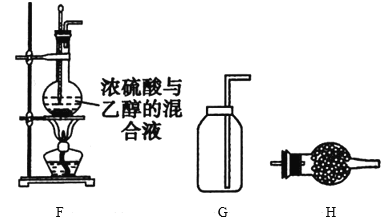
(1)制取并收集一定量的乙烯时必须用到的仪器有___(从题给仪器中选取),写出制备乙烯时的反应方程式:__,实验中,混合浓硫酸与乙醇的方法是__。
(2)已知乙醚的沸点为35℃,利用F装置也可制取乙醚,制备中温度计的水银球位于___(填“溶液中”或“液面上”)。
(3)乙烯制备过程中,烧瓶中的液体很快会变黑,原因是___,生成的气体中除乙烯外还有SO2、CO2气体,为验证上述气体,所用仪器的顺序为FH___,其中H中的试剂是__,确定有乙烯生成的实验现象是__,确定有CO2生成的实验现象是___。
【答案】FEG CH3CH2OH![]() CH2=CH2↑+H2O 将浓硫酸缓慢地倒入乙醇中,并不断搅拌 溶液中 浓硫酸使部分乙醇炭化 CADB 无水氮化钙 溴的CCl4溶液退色 KMnO4溶液的颜色未完全退去而澄清石灰水变浑浊
CH2=CH2↑+H2O 将浓硫酸缓慢地倒入乙醇中,并不断搅拌 溶液中 浓硫酸使部分乙醇炭化 CADB 无水氮化钙 溴的CCl4溶液退色 KMnO4溶液的颜色未完全退去而澄清石灰水变浑浊
【解析】
(1)因乙烯的密度与空气很接近,故应用排水集气法收集乙烯,制取并收集乙烯所用仪器为FEG;制备乙烯时的反应方程式: CH3CH2OH![]() CH2=CH2↑+H2O;混合浓硫酸与乙醇相当于稀释浓硫酸,故应将浓硫酸加入到乙醇中;
CH2=CH2↑+H2O;混合浓硫酸与乙醇相当于稀释浓硫酸,故应将浓硫酸加入到乙醇中;
(2)制备乙醚时需要将温度控制在140℃,故温度计水银球应在反应液中;
(3)浓硫酸具有脱水性,与乙醇混合后会使部分乙醇脱水炭化导致溶液变黑。可用品红溶液检验SO2、用KMnO4溶液除去SO2,但因C2H4也能与KMnO4溶液反应,故检验SO2之前要除去乙烯,为避免SO2被溴氧化,进入溴的CCl4溶液中的气体应该是干燥的,故H中的试剂应该是干燥剂CaCl2或P2O5。仪器的连接顺序为FHCADB。溴的CCl4溶液褪色表明有乙烯生成,KMnO4溶液的颜色未完全退去而澄清石灰水变浑浊表明有CO2生成。
答案为:浓硫酸使部分乙醇炭化;CADB;无水氮化钙;溴的CCl4溶液退色;KMnO4溶液的颜色未完全退去而澄清石灰水变浑浊。