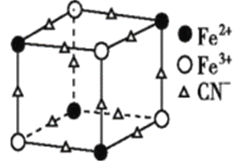
题目内容
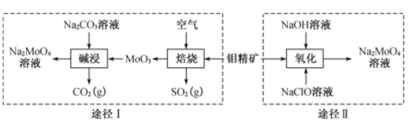
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示。
(1)NaClO的电子式为 ___。
(2)途径Ⅰ碱浸时发生反应的化学方程式为____。
(3)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为____。
(4)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是______[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(5)分析纯钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是_______。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图
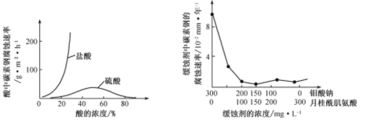
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是____。
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M =206g·mol-1) 的物质的量浓度为____(计算结果保留3位有效数字)。
【答案】![]() MoO3+Na2CO3=Na2MoO4+CO2↑ MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O 90% (NH4)2CO3和(NH4)2SO3 常温下浓硫酸会使铁钝化 7.28×10-4mol/L
MoO3+Na2CO3=Na2MoO4+CO2↑ MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O 90% (NH4)2CO3和(NH4)2SO3 常温下浓硫酸会使铁钝化 7.28×10-4mol/L
【解析】
根据流程利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:
途径Ⅰ是先在空气中灼烧生成MnO3,得到对环境有污染的气体SO2,用碱液可以吸收,然后再用纯碱溶液溶解MnO3,发生反应:MoO3+Na2CO3═Na2MoO4+CO2↑,得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,反应为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,结晶后得到钼酸钠晶体,据此分析作答。
(1)离子化合物NaClO的电子式为![]() ;
;
(2)途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(3)途径II氧化时还有Na2SO4生成,反应物NaClO在碱性条件下氧化MoS2,得到钼酸钠和NaCl、硫酸钠和水,本质为次氯酸根离子氧化MoS2中钼和硫,化合价变化为:升高Mo(+2→+6),S(-1→+6),降低Cl(+1→-1),最小公倍数18,发生反应的离子方程式为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)Ksp(BaMoO4)=4.0×10-8,钼酸钠溶液中c(MoO42-)=0.40molL-1,BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() ,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子的浓度为:c(CO32-)=
,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子的浓度为:c(CO32-)=![]() mol/L=0.01mol/L,则碳酸根的去除率为
mol/L=0.01mol/L,则碳酸根的去除率为![]() =90%;
=90%;
(5)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成正盐为(NH4)2CO3和(NH4)2SO3;
(6)①当硫酸的浓度大于90%时,可以认为是浓硫酸,碳素钢的主要成分含有铁,常温下浓硫酸具有强氧化性,会使铁钝化,表面生成致密的氧化膜,起到防腐蚀作用,所以其腐蚀速率几乎为零;
②缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,据图可知缓蚀效果最好时钼酸钠和月桂酸肌氨酸的浓度均为150mg/L,则1L钼酸钠溶液中钼酸钠的物质的量为![]() ,所以物质的量浓度为7.28×10-4mol/L。
,所以物质的量浓度为7.28×10-4mol/L。