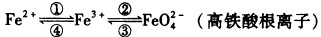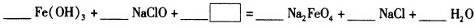题目内容
(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。 现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是_______。
②写出一个包含上述七种物质的氧化还原反应方程式(不需配平) ___________。
③上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:___________________________________________________________________。
(2)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
反应中,被还原的元素是________,氧化产物是______________。
②纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为________。
(3)一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗3.2 g CH3OH转移0.6 mol电子,则氧化产物为(填化学式),氧化产物与还原产物的物质的量之比是________。
(1)①KClH2SO4
②KMnO4+KCl+H2SO4―→K2SO4+MnSO4+Cl2↑+H2O
③KMnO4得到5
④NaBiO3具有强氧化性(比KMnO4氧化性强)
(2)① Au Na2S4O6 ②1∶4
Au Na2S4O6 ②1∶4
(3)CO2. 5:3
解析试题分析:(1)将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则反应物为HCl、KMnO4,且还原剂为HCl,氧化剂为KMnO4;则氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4,反应物为KCl、H2SO4、KMnO4,且还原剂为HCl,氧化剂为KMnO4。
①该反应中Cl元素的化合价升高,H、S、O元素的化合价没有变化,则化合价升高的反应物为KCl,化合价没有发生变化的反应物为H2SO4。
②KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4中反应物为KCl、H2SO4、KMnO4,由电子守恒及质量守恒定律可知反应为2KMnO4+10KCl+8H2SO4═6K2SO4+2MnSO4+5Cl2↑+8H2O。
③该反应中的氧化剂为KMnO4,Mn元素的化合价由+7价降低为+2价,则1mol氧化剂在反应中得到1mol×(7-2)=5mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为高锰酸根离子。
(2)①Au2O3为反应物,则反应中Au2O3→Au2O,Au的化合价由+3价变为+1价,化合价总共降低2×2=4价,Na2S4O6中硫元素平均化合价为+2.5,Na2S2O3中硫元素平均化合价为+2,所以Na2S2O3为反应物,Na2S4O6为生成物,故Na2S2O3转移4e-给Au2O3。被还原的元素是Au,氧化产物是Na2S4O6。
②反应中Na2S2O3→H2SO4,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4
(3)3.2gCH3OH的物质的量为0.1mol,转移0.6mol电子时,化合价变化为6。所以氧化产物为CO2.根据HNO3→N2,由得失电子守恒,则参加反应的HNO3的物质的量为0.12mol,故氧化剂与还原剂的物质的量之比为:0.12:0.1=6:5。氧化产物与还原产物的物质的量之比是0.1:0.06=5:3。
考点:氧化还原反应的计算

水是组成生命体的重要物质,有关水的反应实例有很多。
(1)有人设想将太阳能转化为电能,进而将水电解生成氢气,氢气是一种清洁能源。请分析电解水的过程中,水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(2)野营爱好者携带氢化钙固体作为生氢剂,方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(3)在下列反应中水只被还原的是_____________(填序号)
| A.C+H2O=CO+H2 | B.CaO+H2O=Ca(OH)2 |
| C.3Fe+4H2O=Fe3O4+4H2 | D.3NO2+H2O=2HNO3+NO |
3NO2+H2O=2HNO3+NO
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
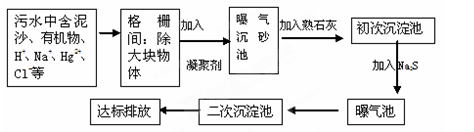
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
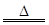 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2