题目内容
【题目】某工厂的工业废水中含有大量的![]() 和较多的
和较多的![]() 和
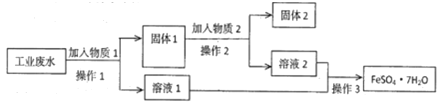
和![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
![]() 检验废水中的
检验废水中的![]() ,实验室中用酸性
,实验室中用酸性![]() 溶液检验,发生反应的离子方程式为______。
溶液检验,发生反应的离子方程式为______。
![]()
![]() 加入过量物质1后,发生反应的离子方程式为______。
加入过量物质1后,发生反应的离子方程式为______。
![]() 固体2是______,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入______。
固体2是______,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入______。
【答案】![]()
![]() 、
、![]() 铜
铜![]() 或
或![]() 铁粉
铁粉![]() 或
或![]()
【解析】
工业废水中含大量硫酸亚铁和较多的![]() 和
和![]() ,从该废水中回收硫酸亚铁和金属铜,先加过量铁,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,结合流程可知,操作1为过滤,过滤出Cu,Fe,滤液1是
,从该废水中回收硫酸亚铁和金属铜,先加过量铁,铁在金属活动顺序表中排在铜的前面,所以铁粉把铜置换出来,结合流程可知,操作1为过滤,过滤出Cu,Fe,滤液1是![]() ,Cu、Fe中加入
,Cu、Fe中加入![]() ,铁与硫酸反应,铜不反应,操作2为过滤,得到固体2为Cu,滤液中主要含
,铁与硫酸反应,铜不反应,操作2为过滤,得到固体2为Cu,滤液中主要含![]() ,操作3为蒸发、浓缩、结晶、过滤,可得到
,操作3为蒸发、浓缩、结晶、过滤,可得到![]() ,以此解答该题。
,以此解答该题。
![]() 亚铁离子与高锰酸钾发生氧化还原反应,反应的离子方程式为
亚铁离子与高锰酸钾发生氧化还原反应,反应的离子方程式为![]() ;
;
![]() 含有铁离子、铜离子,加入过量物质铁后,发生反应的离子方程式为
含有铁离子、铜离子,加入过量物质铁后,发生反应的离子方程式为![]() 、
、![]() ;
;
![]() 由以上分析可知固体2为铜
由以上分析可知固体2为铜![]() 或
或![]() ,硫酸亚铁具有还原性,可被氧化,可加入铁粉,防止被氧化, 故答案为:铜
,硫酸亚铁具有还原性,可被氧化,可加入铁粉,防止被氧化, 故答案为:铜![]() 或
或![]() ;铁粉
;铁粉![]() 或
或![]() 。
。

【题目】某化学小组同学欲在实验室中用乙醇制备1,2-二溴乙烷。
甲同学设计的实验装置如下图:
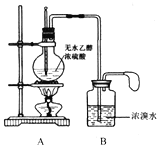
(1)请写出A和B中发生的主要反应的化学方程式
A:________________________________________。
B:________________________________________。
(2)乙同学查阅资料得知:
①此反应可能存在的主要副反应有:在浓硫酸的存在下,乙醇可发生如下反应生成乙醚, ![]()
②乙醚不与溴水反应
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
颜色、状态 | 无色液体 | 无色液体 | 无色液体 |
沸点/℃ | 78.5 | 132 | 34.6 |
若最终产物中混有少量乙醚,可用__________的方法除去。
(3)丙同学观察到:在实验后期A中液体变黑,认为应该在装置A和B之间加入装置__________(填序号),此装置的作用是____________________。