题目内容
【题目】测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如下图所示)。

(1)图中尚缺少的一种仪器是__________
(2)烧杯间填满碎纸屑的作用是__________。
(3)写出反应的热化学方程_____________________(中和热为57.3kJ·mol-1)。
(4)该同学每次分别取0.50mol·L-1 50mL NaOH溶液和0.50mol·L-1 30mL硫酸进行实验,通过多次实验测定中和热ΔH=-53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能是__________(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(5)在测定中和热的实验中,下列说法正确的是(____________)
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol·L-1 NaOH溶液分别与0.5mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计
(6)用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”或“无影响”)。
(7))你认为CH3COOH的中和热与HCl的中和热数值相比,________较大,其原因是______________________________________________________。
(8)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2 ℃ ②2.4 ℃ ③3.4 ℃,则最终代入计算式的温差均值为________ ℃。
【答案】温度计 保温隔热,减少实验过程中热量的损失 H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3kJ/mol b A 偏小 HCl CH3COOH是弱酸,只少部分电离,发生电离时要吸热 2.3
H2O(l) ΔH=-57.3kJ/mol b A 偏小 HCl CH3COOH是弱酸,只少部分电离,发生电离时要吸热 2.3
【解析】
测定中和反应的反应热时,利用的原理是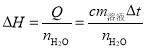 ;使用的试剂是稀的强酸碱,如稀NaOH溶液和稀硫酸,为了保证反应彻底,某一种要稍微过量;由于要测混合溶液反应前后的温度变化,所以实验装置一定要注意保温;在烧杯之间填充碎纸屑,使用环形玻璃搅拌棒而不用金属搅拌棒等都是为了保温,减少热量的散失;为了数据的准确性,一般需要多次测量,通过求温度变化的平均值来更准确地计算中和热。
;使用的试剂是稀的强酸碱,如稀NaOH溶液和稀硫酸,为了保证反应彻底,某一种要稍微过量;由于要测混合溶液反应前后的温度变化,所以实验装置一定要注意保温;在烧杯之间填充碎纸屑,使用环形玻璃搅拌棒而不用金属搅拌棒等都是为了保温,减少热量的散失;为了数据的准确性,一般需要多次测量,通过求温度变化的平均值来更准确地计算中和热。
(1)为了测定反应前后溶液温度的变化,需要用到温度计;
(2)烧杯之间填充碎纸屑,是为了保温隔热,减少热量的散失,从而提高实验的准确性;
(3)中和反应的热化学方程式为:![]()
![]() ;
;
(4)a.实验装置若保温措施不到位,则测得的中和反应放出的热量会偏少,那么最终计算得到的![]() 绝对值偏小,a项可能;
绝对值偏小,a项可能;
b.由于NaOH和H2SO4浓度相同,所以30mL的硫酸相对于50mL的NaOH溶液而言是过量的;在用量筒量取50mLNaOH溶液时,若仰视会导致量取的NaOH偏多;因此中和时会放出更多的热量,进而导致计算的![]() 绝对值偏大,b项不可能;
绝对值偏大,b项不可能;
c.在向烧杯中加入NaOH溶液时,若分多次进行,那么由于热量的散失,会导致记录的温度的变化值比正常值偏低,由此计算的中和反应放出的热量偏少,那么最终计算的![]() 绝对值偏小,c项可能;
绝对值偏小,c项可能;
d.温度计在测完NaOH溶液的温度后,一定要用水冲洗去表面残留的NaOH溶液后再去测量硫酸的温度;若不进行冲洗直接测量,则由于温度计表面残留的NaOH与硫酸反应放热而导致记录的初始温度偏大,进而导致计算的![]() 偏小,那么计算所得的中和反应放出的热量就偏少,由此计算的
偏小,那么计算所得的中和反应放出的热量就偏少,由此计算的![]() 绝对值偏小,d项可能;
绝对值偏小,d项可能;
答案选b;
(5)A.使用环形玻璃搅拌棒搅拌混合后的溶液,让二者反应更快更充分,这样可以减少误差,A项正确;
B.温度计测量的是溶液的温度,不能使其与容器壁接触,B项错误;
C.由于醋酸是弱酸,弱酸的解离过程会吸收热量,因此由其测得的中和热数值与由盐酸测得的不同,C项错误;
D.中和反应反应热的测定实验中不需要用到滴定管,D项错误;
答案选A;
(6)![]() 是弱电解质,弱电解质电离时会吸收热量,因此会导致测得的中和反应放出的热量偏小,由此计算所得的中和热的数值偏小;
是弱电解质,弱电解质电离时会吸收热量,因此会导致测得的中和反应放出的热量偏小,由此计算所得的中和热的数值偏小;
(7)醋酸是弱酸,发生电离时要吸收热量,因此导致醋酸的中和热的数值更小;
(8)由题可知,温度差3.4℃偏离均值过大,所以判定为无效数据,计算平均值时应当在2.2℃和2.4℃之间进行计算,因此代入计算式的温差均值为2.3℃。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1;
O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1;
②H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1。
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1。
气态分子中的化学键 | 断开1mol化学键所需的能量/kJ |
O—H | 465 |
O=O | 498 |
下列说法不正确的是( )
A.氢气的燃烧热ΔH=-241.8kJ·mol-1
B.断开1molH—H键需要吸收439.2kJ的能量
C.相同条件下,1molH2O(g)比1molH2O(l)能量高
D.18gH2O(l)完全分解生成氢气和氧气,需要吸收285.8kJ的能量
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
选项 | 方法 | 现象 | 结论 |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A.AB.BC.CD.D