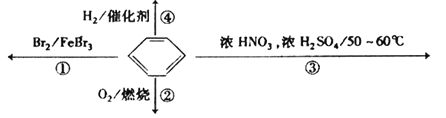
��Ŀ����
����Ŀ����ˮ�Ǿ����Դ���⡣
�Ӻ�ˮ����ȡʳ�κ���![]() ��ˮ�������廯��Ϊ��
��ˮ�������廯��Ϊ��![]() �Ĺ������£�
�Ĺ������£�
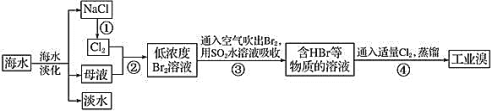
��1����ҵ�������ò�������õ�NaCl�����Ʊ������ƵĻ�ѧ����ʽΪ��______��
��2������ڵ����ӷ���ʽΪ��________��
��3���������![]() ˮ��Һ����
ˮ��Һ����![]() �����Ƶ�����ǿ�ᣬ��ѧ����ʽΪ��_____��
�����Ƶ�����ǿ�ᣬ��ѧ����ʽΪ��_____��
����ֲ���纣���������к��зḻ�ĵ�Ԫ�أ�ȼ�յĻҽ��е�Ԫ����![]() ����ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
����ʽ���ڡ�ʵ������Ӻ�������ȡ����������£�
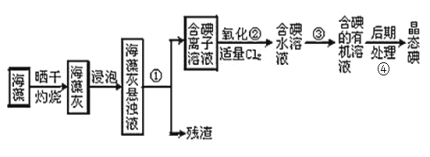
��4��ָ����ȡ��Ĺ������йص�ʵ��������ƣ�
��_____��_____��______
��5����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���_____(����ĸ)��
A�������ƾ� B�����Ȼ�̼���� C�����͡����� D�����͡��ƾ�
���𰸡�2NaCl�����ڣ�![]() Cl2��+2Na Cl2+2Br��Br2+2Cl Br2+SO2+2H2O=2HBr+H2SO4 ���� ��ȡ(��Һ) ���� B
Cl2��+2Na Cl2+2Br��Br2+2Cl Br2+SO2+2H2O=2HBr+H2SO4 ���� ��ȡ(��Һ) ���� B
��������
(1)��ҵ�ϵ�������Ȼ���ұ�������ƣ�
(2)����![]() ����������ĸҺ�е�����������Ϊ�嵥�ʣ�
����������ĸҺ�е�����������Ϊ�嵥�ʣ�
(3) ��![]() ˮ��Һ����
ˮ��Һ����![]() ������������
������������
(4). ![]() �Ƿ��뺣����еĹ����������Һ����
�Ƿ��뺣����еĹ����������Һ����![]() �Ǵӵ�ˮ����ȡ�⣻
�Ǵӵ�ˮ����ȡ�⣻ ![]() �Ǵӵ�����Ȼ�̼��Һ����ȡ�ⵥ�ʣ�
�Ǵӵ�����Ȼ�̼��Һ����ȡ�ⵥ�ʣ�
(4) �ӵ�ˮ����ȡ�⣬ѡ����ȡ����������������ˮ������ⷴӦ�����ܽ�⣻
(1)��ҵ�ϵ�������Ȼ���ұ�������ƣ���Ӧ����ʽ��2NaCl�����ڣ�![]() Cl2��+2Na ��
Cl2��+2Na ��
(2)����![]() �������������ӷ�Ӧ�����嵥�ʣ���Ӧ���ӷ���ʽ��Cl2+2Br��Br2+2Cl��
�������������ӷ�Ӧ�����嵥�ʣ���Ӧ���ӷ���ʽ��Cl2+2Br��Br2+2Cl��
(3) ��![]() ˮ��Һ����
ˮ��Һ����![]() ������������ᣬ��Ӧ����ʽ��Br2+SO2+2H2O=2HBr+H2SO4��
������������ᣬ��Ӧ����ʽ��Br2+SO2+2H2O=2HBr+H2SO4��
(4). ![]() ���뺣����еĹ����������Һ��ʵ������ǹ��ˣ�
���뺣����еĹ����������Һ��ʵ������ǹ��ˣ�![]() ���ݵ��������л��ܼ����ӵ�ˮ����ȡ�⣬ʵ���������ȡ(��Һ)��
���ݵ��������л��ܼ����ӵ�ˮ����ȡ�⣬ʵ���������ȡ(��Һ)�� ![]() ������ķ����ӵ�����Ȼ�̼��Һ����ȡ�ⵥ�ʣ�
������ķ����ӵ�����Ȼ�̼��Һ����ȡ�ⵥ�ʣ�
(4) A���ƾ���ˮ���ܣ����ֲܷ㣬�ʲ�ѡA�� ![]() �����������Ȼ�̼���������Ȼ�̼������������ˮ����ѡB��
�����������Ȼ�̼���������Ȼ�̼������������ˮ����ѡB�� ![]() ������ˮ���ܣ����ֲܷ㣬�ʲ�ѡC��D���ƾ���ˮ���ܣ����ֲܷ㣬�ʲ�ѡD����ѡB��
������ˮ���ܣ����ֲܷ㣬�ʲ�ѡC��D���ƾ���ˮ���ܣ����ֲܷ㣬�ʲ�ѡD����ѡB��

����Ŀ��NH3��Ϊ��Ҫ����ԭ�ϣ�������Ӧ���ڹ�ҵ�����������й����ʷ�Ӧ�Ĵ����о������������863�ƻ���
��1�����Ĵ�������Ӧ:4 NH3��g��+5O2��g��![]() 4NO��g��+6H2O��g�� ��H< 0����������Ļ�����Ӧ�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
4NO��g��+6H2O��g�� ��H< 0����������Ļ�����Ӧ�����ݻ��̶����ܱ������з���������Ӧ�������ڲ������ʵ����ʵ���Ũ�����±���
Ũ�� ʱ�� | C(NH3) mol/L | C(O2) mol/L | C(NO) mol/L |
��0 min | 0.8 | 1.6 | 0 |
��1 min | a | 1.35 | 0.2 |
��2 min | 0.3 | 0.975 | 0.5 |
��3 min | 0.3 | 0.975 | 0.5 |
��4 min | 0.7 | 1.475 | 0.1 |
�ٷ�Ӧ�ڵ�1min����2minʱ��NH3��ƽ����Ӧ����Ϊ______________��
�ڷ�Ӧ�ڵ�3 minʱ�ı����������ı������������___________������ţ���
A��ʹ�ô��� B����Сѹǿ C�������¶� D������O2��Ũ��
��˵��4NH3��g��+5O2��g��![]() 4NO��g��+6 H2O��g���ﵽƽ��״̬����____������ţ���
4NO��g��+6 H2O��g���ﵽƽ��״̬����____������ţ���
A����λʱ��������n mol NO��ͬʱ����n mol NH3
B���ٷֺ���w��NH3��=w��NO��
C����Ӧ����v��NH3����v��O2����v��NO����v��H2O��=4��5��4��6
D���ں��º��ݵ������У���������ƽ����Է����������ٱ仯
��2�������ݻ�Ϊ2L���ܱ������г���4.0molNH3(g)��5.0molO2(g)���������·�Ӧ��4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)�����������������䣬����ͬ��ʱ���ڲ��c(NO)���¶ȵĹ�ϵ����ͼ1��ʾ���� T1���£�NH3��ƽ��ת����Ϊ______��
4NO(g)+6H2O(g)�����������������䣬����ͬ��ʱ���ڲ��c(NO)���¶ȵĹ�ϵ����ͼ1��ʾ���� T1���£�NH3��ƽ��ת����Ϊ______��
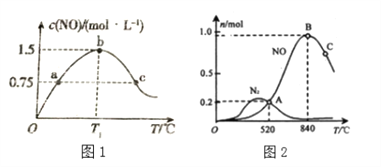
��3����������ʱ�ᷢ������������Ӧ���ֱ�Ϊ
��ӦI��4NH![]() 4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
4NO(g) +6H2O(g) ��H= -905.0 kJ��mol-1
��ӦII: 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1��
2N2(g) +6H2O(g) ��H= -1266.6 kJ��mol-1��
Ϊ����ij�����Ը÷�Ӧ��ѡ���ԣ���1L�ܱ������г���1 mol NH3��2mol O2������й����ʵ�����ϵ����ͼ2��
�ٸô����ڵ���ʱѡ��Ӧ_______(� I ���� II������
��C���B����������NO�����ʵ����ٵ���Ҫԭ��______________________________����4��ͨ����������������Ӧд��NO�ֽ�����N2��O2���Ȼ�ѧ����ʽ________________��
����Ŀ����ɢϵ���ڱȽϹ㷺���ճ������г������̡�������ơ�ʳ��ˮ�ȶ��Ƿ�ɢϵ�����������ַ�ɢϵ�ķ�ɢ�ʺͷ�ɢ����˵���У���ȷ���ǣ� ��
��ɢϵ | ��ɢ�� | ��ɢ�� | |
A | �� | Сˮ�� | ���� |
B | �� | ���� | ���� |
C | ��� | �� | �ƾ� |
D | ʳ��ˮ | ˮ | �Ȼ��� |
A.AB.BC.CD.D
����Ŀ������ʵ�������ʵ����۾���ȷ����
ʵ����� | ʵ����� | |
A | �ȼ�������ˮ���ٵμ�KSCN��Һ������Ѫ��ɫ | ֤��ij��Һ�д���Fe2�� |
B | ��AgCl����Һ�м���NaI��Һʱ���ֻ�ɫ���� | Ksp(AgCl)<Ksp(AgI) |
C | ��̼����еμ����ᣬ�����ݲ��� | ֤���ȵķǽ����Դ���̼ |
D | ��MgCl2��Һ���Ȼ�����������������ᾧ������ | �Ʊ��Ȼ�þ���� |
A. A B. B C. C D. D