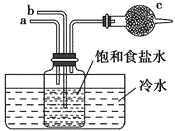
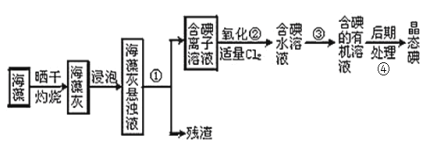
题目内容
【题目】下列实验操作和实验结论均正确的是
实验操作 | 实验结论 | |
A | 先加少量氯水,再滴加KSCN溶液,出现血红色 | 证明某溶液中存在Fe2+ |
B | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向碳酸钙中滴加盐酸,有气泡产生 | 证明氯的非金属性大于碳 |
D | 将MgCl2溶液在氯化氢的气流中蒸发、结晶、过滤 | 制备氯化镁晶体 |
A. A B. B C. C D. D
【答案】D
【解析】
A,先加氯水,再滴加KSCN溶液出现血红色,说明加氯水后的溶液中含Fe3+,Fe3+可能是原溶液中的也可能是氯水氧化得到的,不能说明溶液中一定含Fe2+,A项错误;B,向AgCl悬浊液中加入NaI溶液时出现黄色沉淀,说明AgCl转化成AgI,根据沉淀转化的一般原则,Ksp(AgCl)![]() Ksp(AgI),B项错误;C,CaCO3中滴加盐酸有气泡产生,说明发生了反应CaCO3+2HCl=CaCl2+CO2↑+H2O,根据“强酸制弱酸”的复分解反应规律得出酸性:HCl
Ksp(AgI),B项错误;C,CaCO3中滴加盐酸有气泡产生,说明发生了反应CaCO3+2HCl=CaCl2+CO2↑+H2O,根据“强酸制弱酸”的复分解反应规律得出酸性:HCl![]() H2CO3,HCl不是Cl的最高价含氧酸,不能得出Cl和C非金属性的强弱,C项错误;D,在MgCl2溶液中存在水解平衡:MgCl2+2H2O
H2CO3,HCl不是Cl的最高价含氧酸,不能得出Cl和C非金属性的强弱,C项错误;D,在MgCl2溶液中存在水解平衡:MgCl2+2H2O![]() Mg(OH)2+2HCl,在HCl气流中蒸发,抑制MgCl2的水解,制得氯化镁晶体,D项正确;答案选D。
Mg(OH)2+2HCl,在HCl气流中蒸发,抑制MgCl2的水解,制得氯化镁晶体,D项正确;答案选D。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】已知KMnO4和H2C2O4(草酸)在酸性溶液中会发生氧化还原反应。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用KMnO4溶液均已酸化)
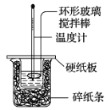
(1)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率,实验装置如图所示:

实验时仪器中的A溶液一次性加入,A、B的成分见下表:
序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
② | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液 |
③ | 2 mL 0.2 mol·L-1H2C2O4溶液 | 4 mL 0.01 mol·L-1KMnO4溶液,少量MnSO4固体(催化剂) |
①盛放A溶液的仪器名称_______,锥形瓶中反应的化学方程式:______
②该实验探究的是_____因素对化学反应速率的影响。在反应停止之前,相同时间内针筒中所得CO2的体积由大到小的顺序是____(填实验序号)。
(2)乙组:通过测定KMnO4溶液褪色所需时间的长短来比较化学反应速率。
取两支试管各加入2 mL 0.1 mol·L-1H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol·L-1KMnO4溶液,将四支试管分成两组(每组各有一支试管盛有H2C2O4溶液和KMnO4溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究________因素对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是______