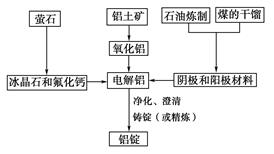
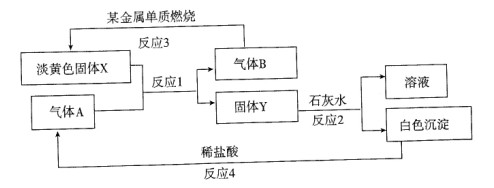
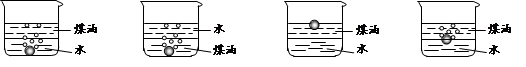题目内容
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。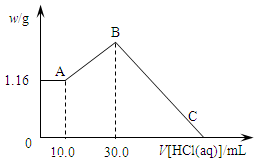
(1)A点的沉淀物的化学式为 。
(2)写出A点至B点发生反应的离子方程式: 。
(3)原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为 mL。
(1)Mg(OH)2 (2)AlO2-+H++H2O=Al(OH)3↓ (3)5.20 130.0
解析试题分析:(1)向所得浊液中,逐滴加入1.00mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0~10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠过量,加入的盐酸与氢氧化铝先反应,方程式为NaOH+HCl=NaCl+H2O。因此A点沉淀是Mg(OH)2,其质量是1.16g,物质的量n= =
= =0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
=0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
(2)NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。NaOH过量,溶液是NaCl、NaAlO2和NaOH的混合液,则A~B阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓。
(3)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100ml,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30ml+100ml=130ml。
考点:考查镁、铝合金与氢氧化钠溶液以及元素反应的有关计算与判断、图像分析与应用

 教材全解字词句篇系列答案
教材全解字词句篇系列答案铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s) △H=-272 kJ·mol-1
FeO(s) △H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中 FeO(s)+CO(g) Fe(s)+CO2(g) △H= 。
Fe(s)+CO2(g) △H= 。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。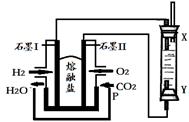
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
| A.X、Y两端都必须用铁作电极 |
| B.可以用NaOH溶液作为电解液 |
| C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- |
| D.白色沉淀只能在阳极上产生 |
纯碱、烧碱等是重要的化工原料。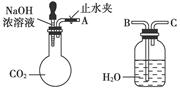
(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,若其他操作不变,将A与C连接,可观察到的现象是 。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是
| A.NaOH和Na2CO3; | |
| B.; | |
| C.; | D.。 |
| 实验操作 | 实验现象 | 结论 |
| (1)取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 | | |
| (2) | | |
(1)元素M是短周期元素,其常量存在于海水中,单质被誉为“国防金属”。
①M的原子结构示意图为______。
②以M、Al为电极,KOH溶液为电解质溶液,则负极的电极反应式为______。
(2)淬火是将金属工件加热到某温度,随即浸入淬冷介质中快速冷却的金属热处理工艺。
①使用水进行淬火,若生成磁性氧化铁,该反应的化学方程式为____________
②验证铁用水淬火后的固体产物是否存在+3价的铁,可选用的试剂为_______ (填序号)
| A.H2O2溶液 | B.铜粉 | C.稀硫酸 | D.KMnO4溶液 |
 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2①图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况。pH =4.74时,反应从开始到800min的平均反应速率v(FeO42—)=______ (保留两位有效数字)。
②图1在800min后,三种溶液中K2FeO4的浓度均不再改变。观察图1判断随着pH 变大,此反应的平衡常数______(填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中K2FeO4的浓度均不再改变,则上述反应的反应热△H______0(填“>”、“<”、“=”)。


 Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题: