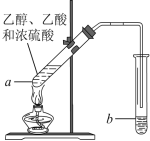
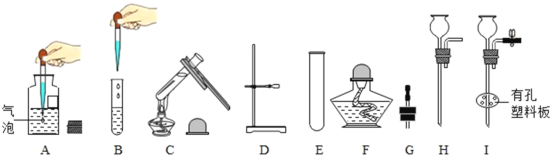
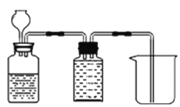
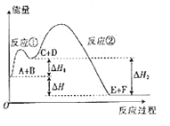
题目内容
【题目】在一定温度下的恒容密闭容器中,不能说明反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)达到平衡状态的是
2NH3(g)+CO2(g)达到平衡状态的是
A. 混合气体的密度不再发生变化
B. 混合气体的总物质的量不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 混合气体的压强不再发生变化
【答案】C
【解析】
当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A项、由方程式可知,反应时,气体总质量增大,体积不变,闭容器中混合气体的密度增大,当密闭容器中混合气体的密度不再发生变化,说明正逆反应速率相等,达到化学平衡状态,故A正确;
B项、由方程式可知,该反应是一个气体体积增大的反应,当混合气体的总物质的量不再发生变化,说明正逆反应速率相等,达到化学平衡状态,故B正确;
C项、由方程式可知,氨气和二氧化碳的化学计量数之比为2:1,密闭容器中氨气的体积分数始终保持不变,混合气体的平均相对分子质量始终保持不变,混合气体的平均相对分子质量不再发生变化,不能说明达到化学平衡状态,故C错误;
D项、由方程式可知,该反应是一个气体体积增大的反应,当混混合气体的压强不再发生变化,说明正逆反应速率相等,达到化学平衡状态,故D正确。
故选C。

练习册系列答案
相关题目