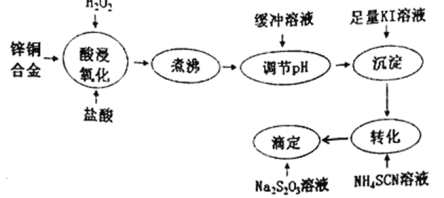
题目内容
【题目】如图为某石英晶体的平面结构示意图,它实际上是立体网状结构(可以看作晶体硅中的每个Si—Si键中插入一个O)。在石英晶体中,氧原子与硅原子的个数的比值和由硅原子、氧原子铁石构成的最小环上Si、O的原子个数之和分别是( )

A.1 8B.2 12C.1/2 8D.1/2 12
【答案】B
【解析】
由石英晶体的平面结构可知(当然立体网状结构也一样),每个Si周围结合4个O,而每个O周围结合2个Si,所以石英晶体中氧原子和硅原子个数之比为2∶1,由于石英晶体是立体网状结构,可以看成晶体硅中的每个Si—Si键上插有一个O(如图所示)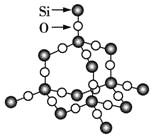 ,因此在石英晶体中,由硅原子、氧原子构成的最小环上具有的Si、O的原子个数之和是12(6个Si和6个O),故B正确。
,因此在石英晶体中,由硅原子、氧原子构成的最小环上具有的Si、O的原子个数之和是12(6个Si和6个O),故B正确。
故选B。

练习册系列答案
相关题目