题目内容
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是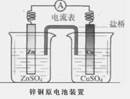
| A.Cu片上发生氧化反应 |
| B.电子由Cu片经外电路流向Zn片 |
| C.盐桥中的Cl―移向ZnSO4溶液 |
| D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
C
解析试题分析:装置中,形成原电池,锌为活泼金属,被氧化而失去电子,铜为原电池正极,正极上得电子而被还原,原电池中,电子由负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动。A、铜为原电池正极,被还原,故A错误;B、原电池中电子由负极经外电路流向正极,故B错误;电解质溶液中阴离子向负极移动,故C正确;D、原电池,锌为活泼金属,被氧化而失去电子,铜为原电池正极,正极上得电子而被还原成铜离子,使溶液中锌离子浓度升高,铜离子浓度降低,故D错误。
考点:原电池和电解池的工作原理

练习册系列答案
相关题目
下列物质的有关事实与电化学腐蚀无关的是
| A.轮船水线以下的船壳上镶嵌有一定量的锌块 |
| B.镀锌的铁制品比镀锡的铁制品耐用 |
| C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀 |
| D.在空气中,金属镁、铝的表面可形成一层氧化膜 |
为使反应:Cu+2H2O=Cu(OH)2+H2↑能够发生,下列设计方案正确的是( )
| A.用铜片作阴、阳电极,电解稀硫酸 |
| B.用铜片作阴、阳电极,电解硫酸铜溶液 |
| C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液 |
| D.用铜片、石墨、氯化钠溶液、导线等组成原电池 |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH > a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
燃料电池能量利用率可高达80%,下列说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物水经过处理之后可供宇航员使用 |
| C.H2SO4作电解质,氢氧燃料电池的负极反应式H2+2OH--2e-=2H2O |
| D.乙醇燃料电池电解质为KOH,负极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
美国圣路易斯大学研制了一种新型的乙醇电池,用质子(H+)溶剂,在200oC左右时供电。电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意如图,下列说法正确的是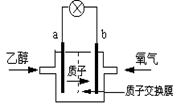
| A.a极为电池的正极 |
| B.电池工作时电子由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e→ 2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
某实验兴趣小组设计如下微型实验装置。实验时,先断开S2,闭合S1,两极均有气泡产生;一段时间后,断开S1,闭合S2,发现电流表A的指针偏转,下列有关描述正确的是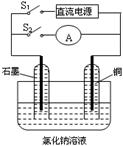
A.断开S2闭合S1时,总反应的离子方程式为:2H++2Cl- H2↑+Cl2↑ H2↑+Cl2↑ |
| B.断开S2闭合S1时,阳极附近溶液变红 |
| C.断开S1闭合S2时,铜电极上的电极反应为:Cl2+2e→2Cl- |
| D.断开S1闭合S2时,石墨电极作正极 |
等物质量浓度的FeBr3和CuCl2的混合溶液用惰性电极电解最初在负极发生反应的离子是( )
| A.Fe3+ | B.Br- | C.Cu2+ | D.Cl- |