题目内容
9.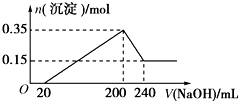 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.(1)加入NaOH0~20mL 时发生反应离子方程式OH-+H+=H2O,加入NaOH20~200mL 时发生反应离子方程式Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3,加入NaOH200~240mL 时发生反应离子方程式Al(OH)3+OH-=AlO2-+2H2O,
(2)镁和铝的总质量为9g
(3)硫酸的物质的量浓度为2.5 mol/L
(4)生成的氢气在标准状况下的体积为10.08L.
分析 (1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此过程中镁离子、铝离子与氢氧根离子反应生成Mg(OH)2和Al(OH)3;从200mL到240mL,NaOH溶解Al(OH)3,据此写出反应的离子方程式;
(2)根据沉淀的最大量可知氢氧化镁和氢氧化铝的总物质的量、最小量,最小量为氢氧化镁,根据最大量可知氢氧化铝的物质的量,然后利用质量守恒计算出镁、铝的物质的量,再根据m=nM计算出混合金属的质量;
(3)溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍,据此计算硫酸的物质的量,进而计算浓度大小;
(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,又硫酸过量所以镁铝全部反应,根据得失电子守恒进行计算.
解答 解:(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,离子方程式为:OH-+H+=H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,发生反应为:Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;从200mL到240mL,NaOH溶解Al(OH)3,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:OH-+H+=H2O;Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)根据天下可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大,Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,
由元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,
所以镁和铝的总质量为0.2mol×27g/mol+0.15mol×24g/mol=9g,
故答案为:9;
(3)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×0.2L×5mol/L=0.5mol,所以硫酸的浓度为$\frac{0.5mol}{0.2L}$=2.5mol/L,
故答案为:2.5;
(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,根据得失电子守恒氢气在标准状况下的体积为:$\frac{0.15×2+0.2×3}{2}$×22.4L=10.08L,
故答案:10.08.
点评 本题考查镁铝的重要化合物及计算,为高频考点,把握图象各阶段的物质的量的关系及各阶段的化学反应为解答的关键,注意反应的先后顺序及利用守恒计算,侧重分析与计算能力的考查.

 计算高手系列答案
计算高手系列答案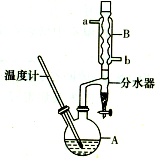 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:2CH3CH2CH2O$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
反应物和产物的相关数据如表:
| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③分离提纯:待A中液体冷却后将其缓慢倒入盛有70mL水的
分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,
分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为:应先加将浓H2SO4滴加到正丁醇中.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应上(填“上”或“下”)口倒出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中加热蒸馏时应收集D(填选项字母)左右的馏分.
A、100℃B、117℃C、135℃D、142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
| A. | 对于可逆反应:H2(g)+Br2(g)?2HBr(g)达到化学平衡后,增大压强时,混合气体颜色变深 | |
| B. | 合成氨工业中温度选择为500°C | |
| C. | 配制Al2(SO4)3溶液时加入少量稀硫酸 | |
| D. | 合成氨工业采用循环操作,可提高原料利用率 |
| A. | 熔融的氢氧化钾 | B. | 液态铜 | C. | 液态氯化氢 | D. | 固态氯化钾 |
| A. | H+ Na+ Mn2+ S2- | B. | Na+ HCO3- Al3+ Cl- | ||
| C. | K+ Na+ Cl- S2- | D. | K+ Cl- Ba2+ OH- |
 目前工业合成氨的原理是:
目前工业合成氨的原理是: 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示: