题目内容
4. 目前工业合成氨的原理是:
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol 回答下列问题:
(1)在恒温恒容密闭容器中进行的工业合成氨反应,下列能表示达到平衡状态的是AB.
A.反应容器中N2、NH3的物质的量的比值不再发生变化
B.混合气体的平均相对分子质量不再发生变化
C.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
D.单位时间内断开3a个H-H键的同时形成6a个N-H键
(2)理论上,为了增大平衡时H2的转化率,可采取的措施是AD.
A.增大压强 B.使用合适的催化剂
C.升高温度 D.及时分离出产物中的NH3
(3)如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数,分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)<vB(NH3)(填“>”、“<”或“=”),该反应的平衡常数KA>KB(填“>”、“<”或“=”),在250℃、1.0×104kPa下达到平衡,H2的转化率为66.7%(计算结果保留小数点后一位)
分析 (1)达到平衡时,正逆反应速率相等,各物质的浓度不变,以此衍生的一些物理量也不变,以此判断是否达到平衡状态;
(2)为了提高氢气的转化率,应使平衡向正反应移动,结合反应的特点分析选项判断平衡移动的方向,然后进行判断;
(3)温度越大,压强越大,反应速率越大;平衡常数只受温度的影响,升高温度平衡向吸热方向移动,吸热反应平衡常数增大.
解答 解:(1)A.混合气体的压强不再发生变化,在恒温恒容密闭容器中,因为合成氨是气体分子数目减小的反应,混合气体的压强不再发生变化,说明达到平衡状态,故A正确;
B.反应前后气体的物质的量不相等,混合气体的相对分子质量不再发生变化,可说明气体的总物质的量不变,说明达到平衡状态,故B正确;
C.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比可能只是某一时刻的比值,不能证明是否达到平衡,故C错误;
D.无论是否达到平衡状态,都存在单位时间内断开3a个H-H键的同时形成6a个N-H键,不能说明达到平衡状态,故D错误;
故选:AB,
故答案为:AB.
(2)A.增大压强,平衡向正方向移动,氢气的转化率提高,故A正确;
B.催化剂只能够同等程度加快反应速率,但是平衡不移动,氢气转化率不变,故B错误;
C.合成氨为放热反应,升高温度平衡逆向移动,氢气的转化率降低,故C错误;
D.及时分离出产物中的NH3,减少生成物浓度,平衡正向移动,氢气转化率提高,故D正确;
故选:AD,
故答案为:AD.
(3)温度越大,压强越大,反应速率越大,由图可知,B对应的温度、压强大,则反应速率大;合成氨的反应是放热的,所以温度升高,速率加快,反应的平衡常数减小,因为A点温度低,所以kA>kB;
在250℃、1.0×104kPa下达到平衡,氨气的体积分数是50%,则设N2的转化量为x,
N2+3H2?2NH3,
初始量:1 3 0
变化量:x 3x 2x
平衡量:1-x 3-3x 2x
$\frac{2x}{1-x+3-3x+2x}$=50%,
解得x=$\frac{2}{3}$,
氢气的转化率=$\frac{\frac{2}{3}×3}{3}$×100%=66.7%;
故答案为:<;>;66.7.
点评 本题考查化学平衡图象、反应速率计算、化学平衡常数、化学平衡状态判断等,侧重于学生的分析能力和计算能力的考查,题目难度中等,熟练掌握化学平衡理论知识是解题关键.

 口算能手系列答案
口算能手系列答案| A. | 由题给△H值可知,该反应是一个放热反应 | |
| B. | △S>0表明该反应是一个熵增加的反应 | |
| C. | 该反应在室温下可能自发 | |
| D. | 不能确定该反应能否自发进行 |
| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 1 |
| A. | 100mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 |
 实验小组用如图所示的实验装置进行实验.
实验小组用如图所示的实验装置进行实验.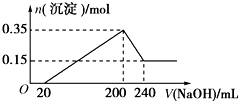 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.