题目内容
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取Al可采用如图所示工艺流程:
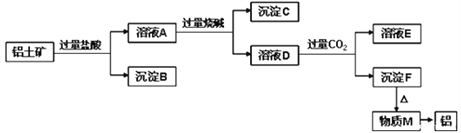
请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为_____________________________。
(2)沉淀B与烧碱反应的离子方程式为______________________________________。
(3)溶液D中通入过量CO2的离子方程式为_____________________________。
(4)“通入过量CO2”能否改用过量盐酸________(填“能或否”),原因是_____________。
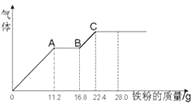
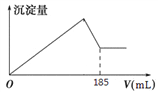
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为_________mol。
【答案】 Al2O3+6H+=Al3++3H2O SiO2+2OH-=SiO32-+H2O AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- CO2+OH-=HCO3- 否 Al(OH)3会溶解在盐酸中 0.035
【解析】Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解可得到Al,则
(1)加入盐酸后生成Al3+的离子方程式为Al2O3+6H+=Al3++3H2O;(2)B为二氧化硅,与氢氧化钠反应生成硅酸钠,反应的离子方程式为SiO2+2OH-=SiO32-+H2O;(3)D含有NaAlO2,通入过量二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(4)因氢氧化铝溶于盐酸,所以不能用盐酸代替二氧化碳;(5)由图象可知氢氧化铝完全沉淀时消耗185mL氢氧化钠,即消耗0.185molNaOH,设含有xmolAl3+,ymolFe3+,涉及离子方程式为Fe3++3OH-= Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,则x+y=0.05、4x+3y=0.185,解得x=0.035。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案