题目内容
【题目】某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是( )
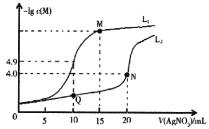
A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
【答案】D
【解析】
A.KCl和硝酸银反应的化学方程式为:![]() ,铬酸钾和硝酸银反应的化学方程式为:
,铬酸钾和硝酸银反应的化学方程式为:![]() ,根据反应方程式可知在相同浓度的KCl和
,根据反应方程式可知在相同浓度的KCl和![]() 溶液中加入相同浓度的硝酸银溶液,氯离子浓度减小的更快,所以
溶液中加入相同浓度的硝酸银溶液,氯离子浓度减小的更快,所以![]() 代表是
代表是![]() 与
与![]() 的变化关系,故 A正确;
的变化关系,故 A正确;
B.M点加入的硝酸银溶液体积是15mL,根据反应方程式![]() 可知,生成
可知,生成![]() 硝酸钾和
硝酸钾和![]() 氯化银,剩余
氯化银,剩余![]() 硝酸银,则
硝酸银,则![]() ,银离子水解使溶液表现酸性,则
,银离子水解使溶液表现酸性,则![]() ,所以M点溶液中,离子浓度为:
,所以M点溶液中,离子浓度为:![]() ,故 B正确;
,故 B正确;
C.N点纵坐标的数值是4,则![]() 在沉淀溶解平衡中
在沉淀溶解平衡中![]() ,
,![]() ,
,![]() ,故C正确;
,故C正确;
D.相同实验条件下同一种溶液的![]() 相同,平衡时溶液中
相同,平衡时溶液中![]() ,Q对应的纵坐标数值是
,Q对应的纵坐标数值是![]() ,即
,即![]() ,曲线
,曲线![]() 中N点移到Q点上方,故D错误。
中N点移到Q点上方,故D错误。

练习册系列答案
相关题目