题目内容
已知某温度下,在2L密闭容器中加入一定量A,发生以下化学反应:2A(g) 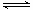 B(g) + C(g);ΔH = ?48.25 kJ/L
B(g) + C(g);ΔH = ?48.25 kJ/L
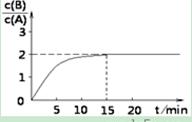
时间t与A 、B的浓度有下图所示关系,若测得第15min时c(B)=1.6 mol/L,则下列结论正确的是( )
A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.0-15min内,气体密度不变
D.要使c(B)/c(A)= 3,只能降低反应温度
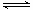 B(g) + C(g);ΔH = ?48.25 kJ/L
B(g) + C(g);ΔH = ?48.25 kJ/L时间t与A 、B的浓度有下图所示关系,若测得第15min时c(B)=1.6 mol/L,则下列结论正确的是( )

A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.0-15min内,气体密度不变
D.要使c(B)/c(A)= 3,只能降低反应温度
C
试题分析:由图可知,15min时反应到达平衡,平衡时c(B)=1.6mol?L-1,c(B)/c(A)=2,故平衡时c(A)=0.8mol/L;A.浓度变化量之比等于化学计量数之比,故平衡时c(C)=c(B)=1.6mol?L-1,故平衡常数表达式k=
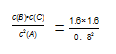 =0.04,故A错误;B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ×6.4/2=154.4kJ,故C正确;D.要使c(B)/c(A)=3,应改变条件使c(B)增大,c(A)降低,可以只增大B的浓度,该反应为放热反应,可以降低温度使平衡向正反应进行,故D错误;
=0.04,故A错误;B.浓度变化量之比等于化学计量数之比,故△c(A)=2c(B)=2×1.6mol?L-1=3.2mol?L-1,A的起始浓度为3.2mol?L-1+0.8mol/L=4mol/L,故A的初始物质的量为4mol/L×2L=8 mol,故B错误;C.参加反应的A的物质的量为3.2mol/L×2L=6.4mol,故放出的热量为48.25kJ×6.4/2=154.4kJ,故C正确;D.要使c(B)/c(A)=3,应改变条件使c(B)增大,c(A)降低,可以只增大B的浓度,该反应为放热反应,可以降低温度使平衡向正反应进行,故D错误;
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示: 2Z(g)、②2M(g)
2Z(g)、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 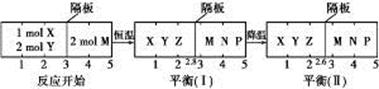

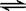 CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
CO2(g)十H2 (g) △H < 0 ;CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+  aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。 FeO(s)+CO(g)△H=Q1的平衡常数为K1,
FeO(s)+CO(g)△H=Q1的平衡常数为K1, CO(g)+H2O(g)△H=Q3
CO(g)+H2O(g)△H=Q3 CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是