题目内容
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
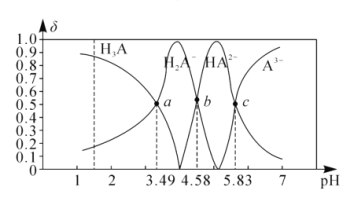
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
【答案】D
【解析】
由曲线分析可知,a点溶液中c(H3A)=c(H2A-),b点溶液中c(HA2-)=c(H2A-),c点溶液中(HA2-)=c(A3-)。
A.a点是H3A和H2A-的物质的量分数相同,浓度相同,溶液显酸性,溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.25℃时,H3A的第二步电离平衡常数K2=![]() ,c(HA2-)=c(H2A-)时,pH=4.58,则K2=10-4.58,数量级为10-5,故B正确;
,c(HA2-)=c(H2A-)时,pH=4.58,则K2=10-4.58,数量级为10-5,故B正确;
C.b点溶液中c(HA2-)=c(H2A-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(H2A-)+2c(HA2-)+3c(A3-)+c(OH-)=3c(H2A-)+3c(A3-)+c(OH-),故C正确;
D.当该溶液中c(HA2-)=c(A3-)时,溶液的pH=5.83,c(H+)=10-5.83,此时溶液中的氢离子主要是HA2-电离产生的,所以c(H+)水=c(OH-)水= ![]() =10-8.17molL-1<10-7molL-1,故D错误;
=10-8.17molL-1<10-7molL-1,故D错误;
综上所述,答案为D。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式_________,E2+价电子的轨道表示式_________________。
(2)这5种元素中电负性最大的元素是_____(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式_____________。