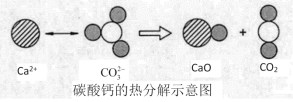
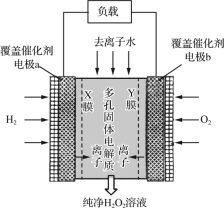
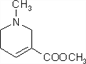
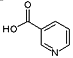
题目内容
【题目】某研究性学习小组采用氢气还原法测定碱式碳酸铜[xCuCO3·yCu(OH) 2·zH2O]的组成,反应原理为 xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+ xCO2+(x+2y+z)H2O。 装置如下:
(x+y)Cu+ xCO2+(x+2y+z)H2O。 装置如下:

请回答:
(1)仪器 D 的名称________, D 中所装药品及目的是_______,_________;
(2)请设计实验验证硬质玻璃管 A 中的碱式碳酸铜是否完全反应___________。
【答案】 干燥管 碱石灰 防止空气中的二氧化碳和水进入C中 将硬质玻璃管中固体加入稀盐酸中,若溶液变蓝,则反应还未完全(或取上层清液滴加NaOH溶液,若产生蓝色沉淀则反应还未完全。其他合理答案均可)
【解析】(1)仪器 D 的名称为干燥管。因为xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+ xCO2+(x+2y+z)H2O。为了防止空气中的水蒸气和二氧化碳干扰,所以 D 中所装药品为碱石灰。答案:干燥管 碱石灰 防止空气中的二氧化碳和水进入C中。
(x+y)Cu+ xCO2+(x+2y+z)H2O。为了防止空气中的水蒸气和二氧化碳干扰,所以 D 中所装药品为碱石灰。答案:干燥管 碱石灰 防止空气中的二氧化碳和水进入C中。
(2)因为xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+ xCO2+(x+2y+z)H2O。可取硬质玻璃管 A 中的物质入稀盐酸中,若溶液变蓝,则反应还未完全(或取上层清液滴加NaOH溶液,若产生蓝色沉淀则反应还未完全)。其他答案符合题意也可。答案:将硬质玻璃管中固体加入稀盐酸中,若溶液变蓝,则反应还未完全(或取上层清液滴加NaOH溶液,若产生蓝色沉淀则反应还未完全。其他合理答案均可)。
(x+y)Cu+ xCO2+(x+2y+z)H2O。可取硬质玻璃管 A 中的物质入稀盐酸中,若溶液变蓝,则反应还未完全(或取上层清液滴加NaOH溶液,若产生蓝色沉淀则反应还未完全)。其他答案符合题意也可。答案:将硬质玻璃管中固体加入稀盐酸中,若溶液变蓝,则反应还未完全(或取上层清液滴加NaOH溶液,若产生蓝色沉淀则反应还未完全。其他合理答案均可)。

 名师金手指领衔课时系列答案
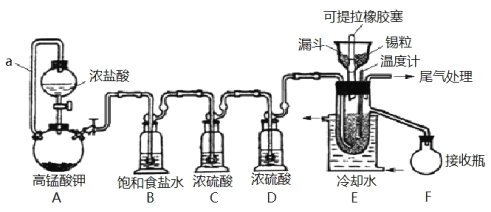
名师金手指领衔课时系列答案【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
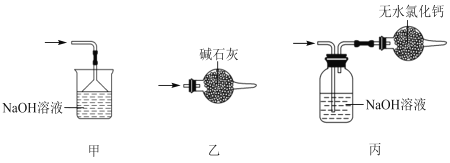
(5)尾气处理时,可选用的装置是___(填序号)。
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶