题目内容
【题目】25℃时,取浓度均为0.1molL-1的醋酸溶液和氨水溶液各20mL,分别用0.1molL-1NaOH溶液、0.1molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是
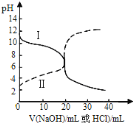
A.曲线Ⅰ:滴加溶液到10mL时![]()
B.曲线Ⅱ:滴加溶液到20mL时:![]()
C.根据滴定曲线,可得![]()
D.由曲线Ⅱ可知,选用酚酞和选用甲基橙作指示剂,消耗NaOH溶液的体积相同
【答案】B
【解析】
A. 曲线Ⅰ表示用盐酸滴定氨水,滴加溶液到10mL时,溶液中的溶质是等物质的量的氨水和氯化铵,溶液呈碱性,氨水电离大于氯化铵水解,所以![]() ,故A错误;
,故A错误;
B. 曲线Ⅱ表示氢氧化钠溶液滴定醋酸,滴加溶液到20mL时,恰好反应,溶质是醋酸钠,根据物料守恒![]() ,根据电荷守,
,根据电荷守,![]() ,所以
,所以![]() ;故B正确 ;
;故B正确 ;
C. 根据滴定曲线,0.1molL-1的氨水溶液pH=11,所以Kb(NH3H2O)= ![]() ≈
≈![]() =10-5 ,故C错误;
=10-5 ,故C错误;
D.曲线Ⅱ表示氢氧化钠溶液滴定醋酸,甲基橙的变色范围是3.1~4.4,酚酞的变色范围是8~10,使酚酞变色需要碱性,选用酚酞作指示剂消耗NaOH溶液的体积大,故D错误;
故答案选B。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】Ⅰ.课堂上,老师提问如何鉴别浓硫酸与稀硫酸,某学习小组设计方案如下
方案 | 结论 | |
① | 往酸中投入火柴梗 | 变黑者为浓硫酸 |
② | 加入铝片 | 产生刺激性气味者为浓硫酸 |
② | 加少量酸于盛水的小烧杯中 | 放热者为浓硫酸 |
④ | 用玻璃棒蘸浓氨水靠近酸的瓶口 | 冒白烟者为浓硫酸 |
⑤ | 将酸滴加到胆矾晶体上 | 变白者为浓硫酸 |
(1)以上方案中,可行的是______________(填序号)
(2)其中一个稍作改进就能成为可行方案是________________,改进方法为____________。
(3)完全错误的是__________,因为_________________________________________。
Ⅱ.实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
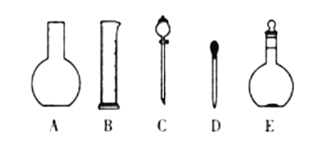
(1)如下图所示的仪器中配制溶液肯定不需要的是____________(填字母),配制上述溶液还需要用到的玻璃仪器是_________________________(填仪器名称)。
(2)容量瓶上标有以下5项中的_____________(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是______________(填序号)。
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为_____________________mL。(保留小数点后一位)