题目内容
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,ΔH1 ____ΔH2(填“>”、“<”或“=”,下同)。
(2)相同条件下,1 mol氮气和氢气反应断键吸收能量____形成2 mol氨气成键所放出的能量。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1___ΔH2。①P4(白磷,s)+5O2(g)= 2P2O5(s) ΔH1, ②4P(红磷,s)+5O2(g)= 2P2O5(s) ΔH2。
(4)25℃ 1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36 kJ热量,该反应的热化学方程式是_______。
(5)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是_______。
(6)已知:C(s)+O2(g)=CO2(g) △H=-437.3kJmol﹣1,H2(g)+![]() O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+
O2(g)=H2O(g) △H=-285.8kJmol﹣1,CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
O2(g)=CO2(g) △H=-283.0kJmol﹣1,煤的气化主要反应的热方程式C(s)+H2O(g)=CO(g)+H2(g) △H=__kJmol﹣1。
【答案】= < < S(s)+O2(g)==SO2(g) △H=-299.52 kJmol﹣1 CH4(g)+H2O==CO(g)+3H2(g) △H=+2a kJmol﹣1 +131.5
【解析】
(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关;
(2)化学键断裂为吸热过程,新键生成放热的过程;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多;
(4)根据题意,求出1 mol S燃烧放出的热量,再根据热化学方程式的含义以及书写方法来回答;
(5)根据热化学方程式的含义以及书写方法来回答;
(6)根据热化学方程式和盖斯定律计算得到,反应焓变与反应过程无关。
(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同;
故答案为:=;
(2)氮气与氢气反应合成氨气,属于放热反应,根据△H=反应物断开吸收的能量-生成物形成放出的能量可知,1 mol氮气和氢气反应断键吸收能量小于形成2 mol氨气成键所放出的能量,故答案为:<;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小;
故答案为:<;
(4) 25℃、1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36 kJ热量,则1mol硫粉充分燃烧放出的热量为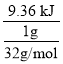 =299.52 kJmol﹣1,故热化学方程式为:S(s)+O2(g)==SO2(g) △H=-299.52 kJmol﹣1;
=299.52 kJmol﹣1,故热化学方程式为:S(s)+O2(g)==SO2(g) △H=-299.52 kJmol﹣1;
(5) 0.5 mol CH4(g)与0.5 mol水蒸气在t℃、p kPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,所以1mol甲烷与1mol水蒸气在t℃、pkPa时,完全反应生成一氧化碳和氢气(合成气),吸收了2akJ热量,热化学方程式为:CH4(g)+H2O==CO(g)+3H2(g) △H=+2a kJmol﹣1;
故答案为:CH4(g)+H2O==CO(g)+3H2(g) △H=+2a kJmol﹣1;
(6)已知
①C(s)+O2(g)=CO2(g) △H=-437.3 kJmol﹣1,
②H2(g)+![]() O2(g)=H2O(g) △H=-285.8 kJmol﹣1,
O2(g)=H2O(g) △H=-285.8 kJmol﹣1,
③CO(g)+![]() O2(g)=CO2(g) △H=-283.0 kJmol﹣1,
O2(g)=CO2(g) △H=-283.0 kJmol﹣1,
依据盖斯定律①②③,得到:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJmol﹣1,故答案为:+131.5。